Теоретические основы процесса флотационного обогащения
 Для проведения процесса флотации в пульпу, представляющую собой смесь тонкоизмельченной руды с водой, загружаются флотационные реагенты, изменяющие степень смачиваемости поверхности минералов. Под действием флотационных реагентов поверхность одних минеральных частиц смачивается водой, т.е. становится гидрофильной, а поверхность других не смачивается водой, т.е. становится гидрофобной. Гидрофобные частицы прилипают к пузырькам (рис. 146) и выносятся на поверхность пульпы, где образуют слой минерализованной пены, которая снимается в виде пенного продукта.
Для проведения процесса флотации в пульпу, представляющую собой смесь тонкоизмельченной руды с водой, загружаются флотационные реагенты, изменяющие степень смачиваемости поверхности минералов. Под действием флотационных реагентов поверхность одних минеральных частиц смачивается водой, т.е. становится гидрофильной, а поверхность других не смачивается водой, т.е. становится гидрофобной. Гидрофобные частицы прилипают к пузырькам (рис. 146) и выносятся на поверхность пульпы, где образуют слой минерализованной пены, которая снимается в виде пенного продукта.
Рис. 146. Схема минерализации воздушного пузырька
Физико – химические явления, происходящие при флотации, очень сложны, т.к. во флотационном процессе участвует три фазы :
- твердая фаза ( минеральные частицы);
- жидкая ( вода);
- газообразная ( воздух).
Поэтому поверхностные явления, происходящие при флотации рассматриваются на границе фаз: жидкой – газообразной (Ж-Г), твердой – жидкой (Т – Ж ) и твердой – газообразной (Т –Г ).
 Поверхность раздела двух фаз отличается по физико-химическим свойствам от свойств в объеме фаз. Это различие заключается в том, что на поверхности раздела фаз имеется избыток свободной энергии. На молекулу А ( рис. 147) ,находящуюся внутри жидкой фазы, действуют силы взаимного притяжения со стороны всех окружающих соседних молекул. В результате этого силы притяжения молекул взаимно уравновешены, сами молекулы находятся Рис.147. Схема действий молекулярных
Поверхность раздела двух фаз отличается по физико-химическим свойствам от свойств в объеме фаз. Это различие заключается в том, что на поверхности раздела фаз имеется избыток свободной энергии. На молекулу А ( рис. 147) ,находящуюся внутри жидкой фазы, действуют силы взаимного притяжения со стороны всех окружающих соседних молекул. В результате этого силы притяжения молекул взаимно уравновешены, сами молекулы находятся Рис.147. Схема действий молекулярных
сил
в состоянии равновесия и для их перемещения внутри жидкости не нужно затрачиватьопределенную работу. Силы молекулярного сцепления действуют лишь на близких расстояниях, поэтому молекулы испытывают притяжение со стороны ближних молекул.
Для молекулы Б,расположенным на поверхности жидкой фазы, ни все силы молекулярного сцепления уравновешены, это объясняется тем, что молекулы в газообразной фазе удалены на значительные расстояния друг от друга и силы их взаимного притяжения ничтожны. Поэтому молекулы, находяжиеся на границе раздела фаз испытывают притяжение только со стороны жидкой фазы. Эти силы не уравновешены и направлены внутри жидкой фазы, т.к. они стремятся втянуть молекулы внутрь жидкости Для создания новой поверхности раздела необходимо затрать работу против сил молекулярного сцепления. Работа, затрачиваемая на образование 1 см2 поверхности раздела фаз или эквивалентная ей свободная энергия, приходящаяся на единицу площади этой поверхности, называется поверхностным натяжением,которая обозначаетсябуквой σ ( сигма) и измеряется в дж/м2 или н/м ( эрг/см2 или дин/см). Поверхностное натяжении воды составляет при 20˚С, например составляет 72,8 дин/ см. Поверхностное натяжение является очень важной характеристикой раздела фаз. Его можно изменить, растворяя в водной фазе различные вещества. Вещества, уменьшающие поверхностное натяжение называются поверхностно-активными (ПАВ).Этим вещества способны накапливаться на границе раздела двух фаз с образованием слоя повышеннойконцентрации – адсорбционного слоя. Обычно это органические соединения, в молекулы которых одновременно входит полярная группа ( ОН. СООН, NH2 ) и аполярная группа ( углеводородная цепь). Растворимые вещества, например, неорганические соли, повышают поверхностное натяжение, поэтому называются поверхностно-инактивные.
В зависимости от химической активности и строения различают полярные, аполярные и гетерополярные вещества. Полярными веществами называют химические соединения, хорошо растворимые в воде и обладающие значительной поверхностной энергией. Молекулы полярных веществ диссоциируют на ионы. К ним относятся органические кислоты и соли, некоторые минералы и др. Аполярные вещества, напротив, химически мало активны, плохо растворяются в воде и не смачиваются ею, обладают незначительной поверхностной энергией и не распадаются в воде на ионы. К ним относятся минеральные масла, жиры и другие органические соединения. Вещества, в состав которых одновременно входят полярная группа и аполярная углеводородная цепь, называются гетерополярными (рис. 148).
 Рис. 148. Строение гетерополярной молекулы
Рис. 148. Строение гетерополярной молекулы
При растворении гетерополярного соединения в воде его молекулы стремятся к границе раздела фаз, где концентрация их больше, чем в объеме раствора. Эти гетерополярные молекулы ориентируются на границе раздела жидкость газ так, что полярные группы их направлены в воду, а аполярные углеводородные радикалы – в газовую фазу. Это объясняется тем, что аполярная группа почти не имеет сродства с водой и выталкивается в газовую фазу. Молекулы ПАВ за счет полярной группы, наоборот, имеют сродство к более полярной фазе – воде.
По виду гидрофильных групп поверхностно- активные вещества принято делить на ионогенные и неионогенные. Ионогенные вещества диссоциируют в воде на ионы, одни из которых обладают адсорбционной активностью, другие – адсорбционно неактивны. Есди адсорбционно активными являются анионы, то такие ПАВ называются анионными или анионноактивными, в противоположном случае – катионными или катионоактивными. Если анионные ПАВ –это органические кислоты и соли, но катионные – основания, обычно амины различной степени замещения и их соли.
Таким образом, в результате концентрации гетерополярных молекул на границе раздела жидкость – газ происходит снижение поверхностного натяжения. Такая самопроизвольная концентрация вещества на границе раздела фаз называется адсорбцией.
Адсорбцию Г (моль/см2) на поверхности раздела фаз можно вычислить по величине поверхностного натяжения раствора с концентрацией вещества С (моль/л). Уравнение, связывающее адсорбцию с изменением поверхностного натяжения, предложено Гиббсом
Г = - 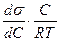 , (94)
, (94)
где R –газовая постоянная, эрг/( моль· град);
T – абсолютная температура, град.
Изменение поверхностного натяжения характеризуется производной dσ/dC в зависимости от концентрации вещества.
Как видно из уравнения Гиббса, адсорбция положительна, когда производная dσ/dC имеет отрицательное значение. В этом случае растворенное вещество будет снижать поверхностное натяжение и концентрация его в поверхностном слое будет больше, чем в объеме раствора. При отрицательном значении адсорбции, когда производная dσ/dC будет иметь положительное значение, концентрация растворенного вещества в поверхностном слое меньше, чем в объеме раствора, и поверхностное натяжение повышается.
Зависимость между поверхностным натяжением и концентрацией раствора ПАВ можно изобразить в виде кривой, представленной на рис. 149, которая строится по экспериментальным данным. Используя такой график и уравнение Гиббса можно расчетом определить величину адсорбции для различных концентраций ПАВ.
Зависимость адсорбции от концентрации ПАВ выражается также уравнением Лангмюра
Г = Г∞  , (95)
, (95)
где Г∞ - предельное значение адсорбции, т.е. полное заполнение поверхности раздела молекулами ПАВ, при толщине слоя в одну молекулу;
b - константа, постоянная для данного вещества, равная концентрации, при которой
Г = 0,5Г∞ и увеличивающаяся при переходе к высшему гомологу в данном гомологическом ряду в 3…3,5 раза.
График зависимости величины адсорбции Г от концентрации С представлен на рис. 150.

Рис. 149. Зависимость поверхностного Рис. 150.Зависимость велисины адсорбции Г
от концентрации С
натяжения  от концентрации поверх-
от концентрации поверх-
ностно-активного вещества С.
Для математического описания адсорбции можно использовать уравнение Фрейдлиха в логарифмической форме
lgГ = lg k +  (96)
(96)
где k и n – постоянные величины при Т = соnst
Как видно, зависимость адсорбции от концентрации ПАВ имеет линейный характер и это позволяет графически определить значение постоянных k и n. Однако уравнение Гиббса не применяется при высоких равновесных концентрациях, в этом случае применяется уравнение Лангмюра.
Явление смачивания твердых минеральных поверхностей является одним из основных физико – химических явлений, определяющих поведение минералов при флотации.
Вода является одной из взаимодействующих фаз и средой, в которой происходит разделение минералов при пенной флотации. Поэтому взаимодействие минералов с водой можно рассматривать как процесс смачивания поверхности минералов, что в свою очередь связано с явлением гидратации.
Как известно, молекула воды характеризуется несимметричным расположением атомов ( рис. 151) и поэтому в молекуле имеется два полюса – положительный и отрицательный. В целом же молекула нейтральна.
 И такая молекула называется полярной. За меру полярности принят дипольный момент µ, который равен произведению заряда е на расстоянии между полюсами l , т.е. µ= e l. Дипольный момент воды равен 1,85 D (Дебай) или 1· 1018 эл-ст.ед.· см.
И такая молекула называется полярной. За меру полярности принят дипольный момент µ, который равен произведению заряда е на расстоянии между полюсами l , т.е. µ= e l. Дипольный момент воды равен 1,85 D (Дебай) или 1· 1018 эл-ст.ед.· см.
Рис. 151. Структура
молекулы воды
 Наличие дипольного момента у молекулы равнозначно наличию электрического поля, поэтому, если в непосредственной близости от полярной молекулы находится другая молекула, то она испытывает действие электрического поля. Так как вода обладает высоким дипольным моментом, то многие вещества под действием диполей воды диссоциируют на ионы, растворяются и гидратируются. Вокруг ионов в воде мгновенно образуется уплотненный слой диполей воды, т.е. ионы гидратируются. Образование такой гидратной оболочки означает, что энергия связи между гидратированными ионами и диполями воды больше, чем между диполями воды. Образование гидратной оболочки вокруг молекул определяется их полярностью. Полярные молекулы гидратируются сильнее аполярных. Гетерополярные молекулы гидратируются в зависимости от структуры. В молекуле будет гидратироваться наиболее сильно полярная группа, в то время как аполярная группа гидратируется намного слабее.
Наличие дипольного момента у молекулы равнозначно наличию электрического поля, поэтому, если в непосредственной близости от полярной молекулы находится другая молекула, то она испытывает действие электрического поля. Так как вода обладает высоким дипольным моментом, то многие вещества под действием диполей воды диссоциируют на ионы, растворяются и гидратируются. Вокруг ионов в воде мгновенно образуется уплотненный слой диполей воды, т.е. ионы гидратируются. Образование такой гидратной оболочки означает, что энергия связи между гидратированными ионами и диполями воды больше, чем между диполями воды. Образование гидратной оболочки вокруг молекул определяется их полярностью. Полярные молекулы гидратируются сильнее аполярных. Гетерополярные молекулы гидратируются в зависимости от структуры. В молекуле будет гидратироваться наиболее сильно полярная группа, в то время как аполярная группа гидратируется намного слабее.
Как же осуществляется процесс смачивания минеральной поверхности водой. Если на поверхность минерала ( твердая фаза – Т) в воздушной среде ( газообразная фаза – Г) поместить коплю воды ( жидкая фаза – Ж), то через некоторое время система придет в равновесие и капля воды примет определенную форму ( рис. 152)
. Тогда на границе раздела трех фаз поверхностное натяжение будет: на границе раздела Ж – Т оно будет σжт, на границе Ж –Г – σжг, на границе Г –Т – σгт.
Возможность смачивания минеральной поверхности можно определить по работе адгезии. Так как под адгезией понимается взаимодействие жидкой и Рис. 152. Схема действий поверхностных твердой фавз на границе их раздела, то работа адгезии
сил на границе раздела трех фаз есть работа, затрачиваемая на отрыв этих разнородных фаз. Когезия – это работа, затрачиваемая на преодоления межмолекулярных сил сцепления при переходе молекул вещества из объема в поверхностный слой. Эта работы равна удвоенному значению поверхностного натяжения вновь образовавшихся при отрыве жидких фаз, т.е.
Wког = 2σжг (97)
Работа адгезии связана с изменением поверхностного натяжения на границе раздела трех фаз
Wадг = σгт + σгж – σжт (98)
В этом уравнении экспериментально можно определить лишь σгж, поэтому Wадг определяется косвенным путем.
Уравнение равновесия поверхностных сил на границе раздела фаз будет
σгт - σтж – σгж cosӨ = 0 (99)
где Ө - равновесный краевой угол смачивания.
Из этого уравнения следует
σгт - σтж = σгж cosӨ (100)
Тогда равновесное значение краевого угла смачивания определяется из формулы
cosӨ =  (101)
(101)
При подставлении это равенство в уравнение работы адгезии получается
Wадг = σгж ( 1 + cosӨ ) (102)
Краевой угол измеряется всегда в жидкую фазу. Величина cosӨ находится в пределах ± 1. При полном смачивании поверхности минерала ( гидрофильная поверхность) Ө = 0, тогда cosӨ = 1, а работа адгезии Wадг = 72,8 ( 1 + 1 ) = 145,6 эрг/ см2.
На абсолютно несмачиваемых поверхностях ( гидрофобная поверхность) Ө = 0, cosӨ = - 1, работа адгезии Wадг = 0. С такой поверхности воздух легко вытесняет воду и прилипает к поверхности. Абсолютно гидрофобных тел в природе нет. Даже на парафине краевой угол равен 104…107˚. Примером гидрофильного минерала может служить совершенно чистый кварц.
Основной акт флотации – это закрепление минеральной частицы на пузырьке воздуха. Этот самопроизвольный процесс основан на втором законе термодинамики, согласно которому самопроизвольно могут осуществляться процессы, приводящие к уменьшению свободной энергии системы.
Убыль свободной поверхностной энергии может быть определена по уравнению
ΔF = σжг  ,(103)
,(103)
Где ΔF – убыль свободной поверхностной энергии системы, отнесенной к единице вновь образованной поверхности раздела твердое – газ,
σжг - свободная поверхностная энергия единицы поверхности раздела жидкость – газ;
Sжг и S1жг – площади поверхности раздела жидкость – газ до и после прилипания пузырька к твердой поверхности;
Sтг – площадь поверхности раздела твердое – газ;
Ө - равновесный краевой угол смачивания, определяемый по уравнению.
При пенной флотации, когда размеры частиц малы по сравнению с размерами пузырьков отношение (Sжг - S1жг)/ Sтг ~ 1, тогда максимальная работа, которая может совершить система при вытеснении жидкости воздухом с единицы поверхности минерала будет ΔF = σжг ( 1 – cos Ө) . Когда Ө>0, то ΔF>0, т.е.прилипание частицы к пузырьку возможно, если краевой угол смачивания Ө>0.
При прилипании минеральной частицы к пузырьку воздуха обязательно образуется краевой угол и чем он будет больше, тем прочнее прилипание. Величину краевого угла можно изменять, обрабатывая минеральную поверхность флотационными реагентами и по его величине судить о способности минералов смачиваться водой. т.е. о их флотируемости. Краевой угол, таким образом, является мерой смачиваемости поверхности.
Практика флотации показала, что минеральные частицы могут флотироваться не только тогда, когда краевой угол больше 90˚, но и тогда, когда значение его меньше 90˚. Так многие минералы флотируются при значение краевого угла 10…15˚.
Рассмотренные закономерности и зависимости справедливы лишь для статических условий, в то время как процесс прилипания минеральных частиц к пузырькам воздуха происходит в пульпе при непрерывном и интенсивном перемешивании. Прилипание, а следовательно, и флотируемость минералов зависит от большого количества факторов, к которым относятся: физико-химические свойства флотируемых минералов и их крупность, свойства и концентрация флотационных реагентов, степень аэрации пульпы, турбулентность при ее перемешивании, крупность пузырьков воздуха, вероятность столкновения частиц с пузырьками.
При рассмотрении явления смачивания необходимо учитывать наличие гистерезиса смачивания, которое проявляется в том, что краевой угол смачивания обычно не принимает своего равновесного значения. Основной причиной гистерезиса смачивания является проявление сил трения, действующих вдоль периметра смачивания. Если на горизонтальную поверхность минерала в воде поместить пузырек воздуха, то образуется равновесный краевой угол ( рис. 153).
 При наклоне поверхности периметр прикрепления пузырька или периметр смачивания остается неизменным, а краевых углов образуется два – причем оттекающий угол Ө2 будет больше равновесного, а натекающий угол Ө1 меньше равновесного.
При наклоне поверхности периметр прикрепления пузырька или периметр смачивания остается неизменным, а краевых углов образуется два – причем оттекающий угол Ө2 будет больше равновесного, а натекающий угол Ө1 меньше равновесного.
Рис. 153. Явление гистерезиса
смачивания
Таким. образом, изменение периметра смачивания отстает от изменения краевого угла. Это отставание в изменении периметра смачивании называется гистерезисом смачивания.
Гистерезис смачивания объясняется микрошероховатостью поверхности, силами трениями, образованием на поверхности минерала адсорбционного слоя ориентированных молекул, ополярные концы которого могут препятствовать растеканию воды на твердой поверхности. На шероховатой, неровной поверхности минерала гистерезис смачивания проявляется значительно больше, поэтому прилипание пузырька воздуха к такой поверхности и флотируемость частиц улучшается. Однако до сих пор не существует единого мнения о роли гистерезиса смачивания при флотации.
В процессе флотации пузырек воздуха минерализуется благодаря прилипанию к нему большого количества минеральных частиц. Это прилипание с образованием агрегата частица – пузырек принято называть элементарным актом флотации.
Столкновение пузырьков с минеральными частицами обычно происходит при движении пузырьков снизу вверх, когда частица под действием силы тяжести падает или при движении частицы вверх, когда поднимающийся пузырек движется с большей скоростью и сталкивается с ней. После столкновения происходит разрыв водной прослойки между ними. Минеральная частица огибает пузырек, толщина водной прослойки между ними постепенно уменьшается. Если поверхность минерала плохо смачивается, то прослойка воды неустойчива и достигнув малой толщины, разрывается самостоятельно, но не до конца. Оставшаяся тонкая устойчивая пленка не препятствует прилипанию частицы минерала к пузырьку. На гидрофобной поверхности частицы водная прослойка, достигшая минимальной толщины, при которой она становится термодинамически неустойчивой, разрывается мгновенно, скачкообразно, этот момент и соотвестствует элементарному акту прилипания частицы к пузырьку, т.е. образованию трехвазного периметра смачивания и краевого угла смачивания. Причем на участке прилипания частицы к пузырьку в пределах площади прилипания остается тонкая пленка воды, являющаяся новой двухмерной фазой, принципиально отличной по своим свойствам от свойств объемной жидкости (рис.154).

Рис.154. Схема прилипания пузырька воздуха к минеральной частице через тонкую пленку воды
1,2 – переходные слои на границе раздела Г-Ж и Т-Ж; 3 –тонкая пленка между пузырьком и минеральной частицей
Толщина водной прослойки в этом случае равна 400Å.
Если поверхность минеральной частицы будет достаточно гидрофильной, то водная прослойка между частицей и пузырьком будет толстой и термодинамически устойчивой, поэтому краевой угол будет небольшим и прилипания не произойдет – пузырек оттолкнется от частицы.
Образование начальной площади прилипания на минеральных частиц облегчается, когда микропузырьки воздуха образуются непосредственно на поверхности минерала. Затем крупный пузырек сливается ( коалесцирует) с этими мелкими пузырьками и использует имеющуюся под ними площадь прилипания. Предполагается, что образование на поверхности гидрофобных частиц микропузырьков воздуха способствует удалению гидратной пленки с поверхности минералов.
Прилипание частиц к пузырьку обычно рассматривается в кинетических условиях, когда важна не только прочность, но и скорость прилипания. Считается, что при минерализации пузырька продолжительность прилипания частиц к пузырьку воздуха находится в пределах 0,0001…0,015 с.
Для осуществления флотации минеральных частиц, прилипших к пузырьку, последний должен поднять их на поверхности пульпы. Минерализованный пузырек при всплывании в пульпе, испытывает помимо силы трения, тяжести частиц и силы инерции воздействие различных механических сил ( столкновение с другими минеральными частицами, пузырьками, турбулентных струй пульпы, движущихся частей флотационных машин и др.) которые могут оторвать частицы от пузырька. Чтобы частица не оторвалась, прочность ее прилипания должна быть достаточной для удержания частицы на поверхности пузырька. Эта прочность зависит от площади прилипания, размера пузырька и величины краевого угла смачивания, а также от массы частицы. Чем больше плотность частицы и ее размеры тем больше отрывающие силы.
С учетом динамических сил, действующих на частицы при их движении в пульпе, и центробежных сил инерции, развиваемые в момент огибания частицей пузырька, силы отрыва частицы увеличивается в среднем в 4…5 раз по сравнению с силой тяжести частицы, а краевой угол возрастает при этом в 1.2…3 раза.
Дата добавления: 2015-06-10; просмотров: 3902;
