Перекисного окисления липидов (ПОЛ)
В патогенезе многих патологических состояний важная роль принадлежит свободным радикалам и активируемому ими перекисному окислению липидов (ПОЛ). Известно, что в органических молекулах электроны на внешней электронной оболочке располагаются парами – одна пара на каждой орбитали. Свободные же радикалы отличаются от обычных молекул тем, что у них на внешней электронной оболочке имеется неспаренный электрон. Это делает радикалы химически активными, так как радикал либо стремится вернуть себе недостающий электрон, отняв его от окружающих молекул, либо отдать лишний. Следовательно, свободные радикалы могут представлять собой атом, группу атомов с неспаренным электроном.
Неспаренный электрон принято обозначать точкой. Так, например, радикал гидроксила обозначают НО*, радикал перекиси водорода – НОО*, радикал супероксида О2*–. Все активные формы кислорода образуются в результате кислородных свободнорадикальных реакций (СРО).
Субстратом свободнорадикальных реакций в биологических системах может быть не только кислород, но и липиды, белки, нуклеиновые кислоты и другие вещества. Под ПОЛпонимают окисление посредством присоединения двух атомов кислорода к углероду с образованием липидных перекисей, липидных перекисных радикалов и других соединений. Непосредственным субстратом ПОЛ могут быть ненасыщенные жирные кислоты, которыми богат липидный слой клеточных и субклеточных мембран.
Процессам ПОЛ способствует активация фосфолипазы А2, запускающая метаболизм арахидоновой кислоты. При этом в конечном итоге образуются супероксиды – простагландины G2 и H2, физиологические усиливающие СРО. Активаторами фосфолипазы А2 могут быть цитокины (IL-1, TNFa), а также С5а фрагмент комплемента, тромбин и другие соединения.
Наличие активных форм кислорода (АФК) играет чрезвычайно важную роль. АФК необходимы не только для поддержания и регуляции «вязкости» мембраны, но и для «разборки» деструктивных (детритных) клеточных масс перед запуском процессов регенерации. Активные формы кислорода ответственны за противомикробную защиту. Миелопероксидаза (МП), переводя Н2О2 в галогенизированные формы радикалов кислорода, образует самые мощные бактерицидные агенты – *ОCl, *OBr, *OJ. При врождённой или приобретенной неддостаточности МП люди нежизнеспособны. Острые инфекционные заболевания сопровождаются обычно повышением синтеза МП. Особенно много МП, по сравнению с другими фагоцитами, в нейтрофилах, благодаря чему эти клетки активируются всего один раз и после реакции высвобождения лизосом гибнут.
Высокая окислительная способность кислорода, необходимая для тканевого дыхания, из пользы может превратиться во вред, если будет направлена на окисление различных субстратов живой клетки. Эти самопроизвольные неферментативные реакции всегда начинаются с одноэлектронного восстановления молекулярного кислорода, приводя к образованию супероксида (О2*–). Процесс образования в клетке О*2– протекает чрезвычайно медленно и в то же время грозит тяжелыми необратимыми последствиями, так как окисляются не специально выбранные субстраты дыхания, а любые ингредиенты цитоплазмы с подходящим потенциалом.
Кислород, будучи небольшой нейтральной молекулой, может чрезвычайно легко проникать через мембрану внутрь клетки. В то же время мембрана клетки является ловушкой для супероксида, так как О2*– заряжен, а стало быть гидротирован и не может пройти сквозь мембранный барьер. В процессе эволюции в клетках появился особый фермент – супероксидисмутаза (СОД). СОД катализирует реакцию взаимодействия (дисмутации) двух супероксидных радикалов с образованием нейтральной Н2О2, способной с легкостью выходить из клетки:
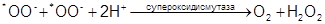
В то же время превращение О2*– в Н2О2 – далеко не безобидный процесс, ибо перекись водорода служит источником радикала НО*, наиболее опасного из продуктов реакции, вызванной одноэлектронным восстановлением атома кислорода.
Свободным радикалом, образуемым живыми клетками (эндотелиоцитами, различными фагоцитами, нейронами и др.), является монооксид азота (*NO), часто называемый окисью азота. В присутствии соединений, содержащих SH-группы, из NO образуется фактор, расширяющий кровеносные сосуды. Недостаток этого фактора является основной причиной развития гипертонической болезни.
Предполагается, что цитотоксическое действие NO обусловлено его реакцией с супероксидом, благодаря чему создается пероксинитрит (O=N-O-ОН), который способен разлагаться с образованием радикального гидроксила *ОН, приводящего к повреждению клеток.
При образовании свободных радикалов в организме (это явление нередко называют окислительным стрессом) в результате процессов пероксидации липидов происходит нарушение свойств биологических мембран и функционирования клеток.
Так, ПОЛ сопровождается окислением тиоловых (сульфгидрильных) групп мембранных белков, обусловленным неферментативной реакцией SH-групп со свободными радикалами липидов. При этом образуются сульфгидрильные радикалы, которые могут преобразоваться в сульфоновую кислоту. Связанное с ПОЛ окисление белков в хрусталике глаза заканчивается его помутнением (катаракта). Немалую роль в патологии клетки играет активация ион-транспортных ферментов, в активный центр которых входят тиоловые группы и в первую очередь Са2+-АТФ-азы. Инактивация этого фермента в результате ПОЛ приводит к замедлению откачивания Са2+ из клетки, и даже, наоборот, к входу Са2+ в клетку, благодаря чему наступает её повреждение. Наконец, окисление сульфгидрильных групп мембранных белков приводит к появлению дефектов во внутреннем липидном слое мембран клеток и митохондрий. Через такие поры в клетку входят ионы Na+, а в митохондрии – ионы Ca2+. В результате внутри клетки и митохондрий повышается осмотическое давление, что приводит к повреждению и нарушению функции клетки.
Другой результат ПОЛ связан со способностью продуктов пероксидации увеличивать ионную проницаемость липидного слоя, в том числе для ионов Н+ и Са2+, что сопровождается потерей митохондриями способности синтезировать АТФ, благодаря чему клетки оказываются в условиях энергетического голода.
Наконец, пероксидация ведёт к уменьшению стабильности липидного слоя, что может привести к электрическому пробою собственным мембранным потенциалом, или потенциалом действия. Электрический пробой приводит к полной потере мембраной её барьерных функций.
Для того чтобы перечисленные реакции были менее опасными, клетки используют ферменты каталазу, пероксидазы (глутатионпероксидазуи др.) и церулоплазмин. Каталаза расщепляет перекись водорода до кислорода и воды, а пероксидазы окисляют перекисью водорода специально выбранные для этой цели субстраты, например такие, как глютатион. Кроме того, имеются и другие антиоксиданты, которые способны реагировать без участия ферментов с продуктами одноэлектронного восстановления кислорода и другими радикалами. Одни из них (витамин Е, витамин А, каротиноиды, убихиноны) локализованы в мембране, другие (аскорбиновая кислота) находятся в самих клетках. Механизм действия этих веществ заключается в том, что они являются эшелоном обороны, подставляющим себя под удар реактивным производным кислорода и, окисляясь, прерывают опасную для клетки цепь реакций.
Из ряда липорастворимых антиоксидантов в мембране особый интерес представляют убихиноны(в частности, убихинол или коэнзим Q), как единственные полипреноиды, способные к синтезу de novo и обладающие ферментной системой регенерации от окислительных до восстановительных форм этих коферментов.
Таковы краткие представления о процессах перекисного окисления липидов.
Дата добавления: 2015-06-10; просмотров: 1218;
