Металлы
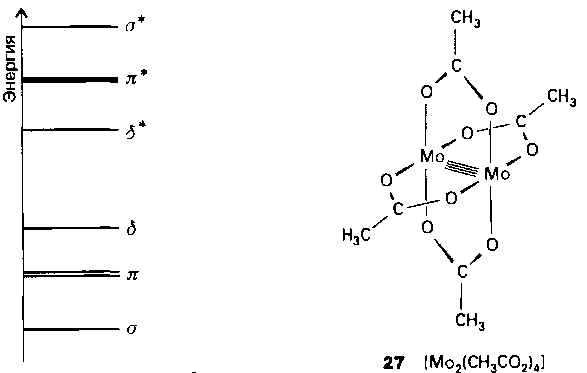
Рис. 9.21. Схематическое изображение диаграммы энергетических уровней молекулярных орбиталей для связи М - М в тетрагонально-призматическом биядерном кластере.
Оставшаяся dx2-y2-орбиталь используется для ó-связей М - L. Четверная связь М - М образуется в том случае, когда все связывающие орбитали заполнены (конфигурация ó2π4б2, рис. 9.21). Наличие четверной связи в кластере [Re2Cl8]2- очевидно из того, что лиганды Сl двух атомов рения находятся напротив друг друга, хотя это невыгодно стерически. Такая заслоненная конфигурация возможна только при наличии б-связи. Другим хорошо известным примером соединения с четверной связью является ацетат молибдена(П) (27), который получают нагреванием соединения молибдена (0) Мо(СО)6 с уксусной кислотой:

Ацетатный комплекс молибдена с четверной связью является отличным исходным реагентом для получения других молибденовых кластеров. Например, хлоридный комплекс с четверной связью получается при обработке Мо2(O2ССН3)4 концентрированной соляной кислотой при температуре ниже комнатной:

Как видно из табл. 9.9, тройная связь металл-металл образуется в комплексах, имеющих структуру тетрагональной призмы, когда заполнены и б- и б*-орбитали. Таких комплексов больше, чем с четверной связью, а поскольку б-связи слабые, длины связей М - М в кластерах обоих типов близки. Многие комплексы с тройной связью также имеют мостиковые лиганды (табл. 9.9). Из таблицы видно, что, если б- или б*-орбиталь занята одним электроном, формально порядок связи равен 3,5.
Металлы d-блока периодической системы
Таблица 9.9. Примеры тетрагонально-призматических комплеков со связями металл— металла
Комплекс Конфигурация Порядок Длина связи
связи М-М, А

Глава 9. Металлы
Таблица 9.9. (Продолжение)
Комплекс Конфигурация Порядок Длина связи,
связи М—М, А
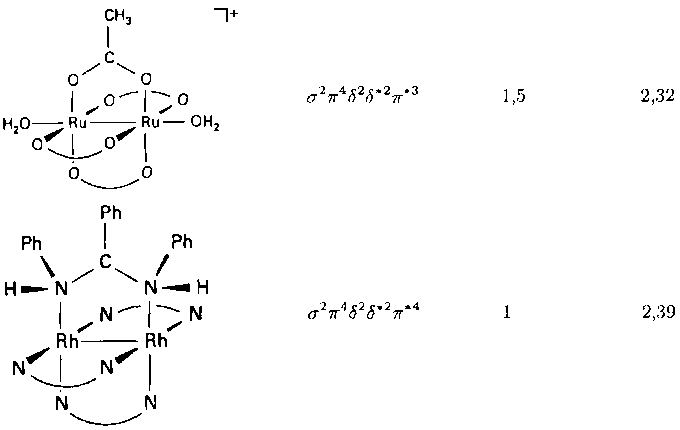
Детально показан только один из сложных мостиковых лигандов. [Cotton F. А., Wilkinson G., Advanced inorganic chemistry. Wiley, New York, 1988; Cotton F. A., Chem. Soc. Rev., 12, 35 (1983)]
После того как все б- и б*-орбитали заполнены, начинается заполнение двух более высоких по энергии π*-орбиталей, при этом порядок связи понижается от 2,5 до 1.
Как и кратные связи в соединениях углерода, кратные связи металл-металл участвуют в различных химических реакциях, однако образующиеся при этом структуры разнообразнее, чем в случае органических соединений1). Например:

где Ср означает циклопентадиенильную группу С5Н5. В этой реакции HI присоединяется по тройной связи, причем и водород, и иод образуют мостики между двумя атомами металла. Таким образом, эта реакция совершенно не похожа на взаимодействие НХ с алкином, где образуется замещенный алкен. Можно
1) Reactivity of metal-metal bonds, ed. Chisholm M.H. ACS Symposium Series 155. American Chemical Society, Washington DC, 1981: McCarley R. E., RyanT.R., Torardi С. М. C., p. 41; Walton R. A., p. 207; Curtis M. D. et al., p. 221; Dyke A. F. et al., p. 259.
Металлы d-блока периодической системы
считать, что продукт реакции содержит мостиковую (Зс-2е)-связь М—Н—М, а атом I связан обычными (2с-2е)-связями с каждым атомом Мо.
Присоединением по кратной связи можно получать кластеры с ббльшим числом атомов металла. Например, кластер с тремя атомами металла образуется при присоединении [Рt(РРh3)4] к тройной связи Мо—Мо, при этом отщепляются две молекулы трифенилфосфина:

Элементы левой части 4d- и 5d-ряда в низких степенях окисления могут образовывать с π-донорными лигандами кластеры с порядком связи металл-металл до четырех. Кратные связи чувствительны к атаке Н+ или комплексов металлов с большим числом электронов, причем последние образуют более крупные кластеры.
Пример 9.3. Определение возможной структуры галогенидов металлов.
Перечислите основные структурные классы галогенидов d-металлов и определите наиболее предпочтительный структурный класс для a) MnF2; б) WChl2; в) RuF6; г) Fel2
Ответ. Дифториды 3d-металлов (MnF2) имеют структуру рутила, характерную для ионных соединений АB2; более тяжелые галогениды (Fel2) обычно слоистые. В хлоридах, бромидах и иодидах 4d- и 5d-металлов начала ряда с низкими степенями окисления есть связь металл-металл (WCl2 является представителем этого класса и содержит кластер W6). Гексагалогениды являются молекулярными соединениями (RuF6).
Вопрос 9.3. Опишите возможное строение соединения, образующегося при взаимодействии Re3Cl9 с раствором, содержащим PPh3.
9.10. Благородные металлы
Металлы правой части d-блока периодической системы устойчивы к окислению. Наиболее характерно это для серебра, золота и 4d- и 5d металлов с 8-й по 10-ю группы (рис. 9.22). Последние называются платиновыми металлами, так как они встречаются в минералах платины. Медь, серебро и золото в соответствии с их традиционным использованием называют монетными металлами. В природе золото встречается в виде самородного металла. Серебро, золото и платиновые металлы получают также при электролитическом рафинировании меди. Стоимость индивидуальных (чистых) платиновых металлов варьируется в широких пределах, поскольку получают их вместе, в смеси, но их потребление не пропорционально распространенности. Родийсамый дорогой металл этой группы, так как он широко используется как катализатор в промышленности и в автомобильных каталитических конвертерах (гл. 17). Родий примерно в 40 раз дороже каталитически менее активного палладия, хотя они близки по распространенности.
Глава 9. Металлы
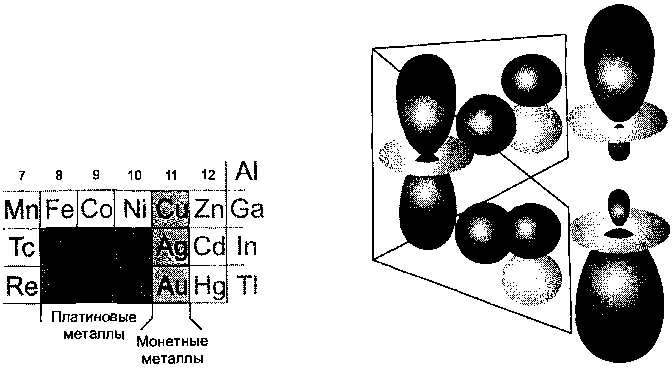
Рис. 9.22. Положение платиновых ме-таллов и монетных металлов в периодической системе.

Рис. 9.23. Гибридизация s-, pz- и dz2-орбиталей, имеющих фазы, указанные на рисунке, приводит к образованию двух расположенных вдоль одной прямой орбиталей, которые могут давать прочные ó-связи.
Медь, серебро и золото не окисляются ионами водорода в стандартных условиях, такой «благородный» характер объясняет их использование вместе с платиной в ювелирном деле. «Царская водка» — смесь в соотношении 3 : 1 концентрированных соляной и азотной кислот — старый, но эффективный реагент для окисления золота и платины. Она оказывает двойное действие: ион NO3 является окислителем, а ион Сl- - комплексообразователем. Уравнение реакции в целом выглядит так:
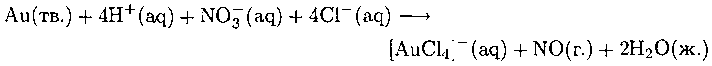
Активными частицами в растворе могут быть также Сl2 и NOCl, которые образуются по реакции:
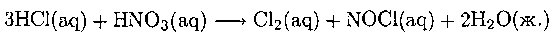
Элементы 11-й группы имеют разные типичные степени окисления. Для меди наиболее характерны степени окисления +1 и +2, тогда как для серебра — +1, а для золота — преимущественно +1 и +3. В водных растворах простые акваионы Cu+(aq) и Au+(aq) подвергаются диспропорционированию:

Комплексы Cu(I), Ag(I) и Au(I) обычно линейные. Например, [H3NAgNH3] + образуется в водных растворах, а линейный комплекс [XAgX]- обнаружен в кристаллах с помощью рентгенографии.
Металлы d-блока периодической системы
Наиболее приемлемым объяснением склонности к образованию линейных комплексов является близость по энергии внешних ns-, пр- и (n — l) d-орбиталей, что способствует формированию линейных spd-гибридных орбиталей (рис. 9.23).
Мягкий характер ионов Cu+, Ag+ и Аu+, являющийся также результатом относительно небольшой разницы энергий граничных орбиталей этих ионов, иллюстрируется тем, что прочность связи в галогенидах меняется по ряду I > Br > Сl. Комплексообразование, например образование [Cu(NH3)2]+ и [Аul2]-, является методом стабилизации соединений этих металлов в степени окисления +1 в водных растворах. Для Cu(I), Ag(I) и Au(I) также известно много тетраэдрических комплексов.
Плоские квадратные комплексы характерны для платиновых металлов и золота в той степени окисления, которая приводит к образованию d8-конфигурации центрального иона, т. е. Rh(I), Ir(I), Pd(II), Pt(II) и Au(III). Примером такого комплекса является [Pt(NH3)4]2+. Для этих соединений характерны реакции обмена лигандов (разд. 7.8) и, кроме Au(III), окислительного присоединения. В последней реакции лиганд XY распадается на две частицы X и Y, которые присоединяются в качестве лигандов, образуя шестикоординационный комплекс:

Эти реакции называют реакциями окислительного присоединения, так как в результате формально увеличивается степень окисления центрального атома металла при присоединении неметаллической частицы с формулой XY, например Н2, CH3l или НСl. В приведенных выше реакциях степень окисления платины меняется с II до IV, а иридия — с I до III. Поскольку неметаллическим атомам, связанным с металлом, приписывается отрицательная степень окисления, присоединение X и Y приводит к увеличению на 2 степени окисления металла. Механизм катализа с участием платиновых комплексов часто включает такой тип реакций (разд. 17.3).
Свойства комплексов платины с органическими лигандами обсуждаются в гл. 16. Была обнаружена интересная серия комплексов Pt(I) и Pd(I), в которых существует связь М—М, и эти атомы также связаны мостиковыми фосфиновыми лигандами (28). Такие комплексы вступают в реакции с двухэлектронными лигандами, которые внедряются по связи М—М:
Глава 9. Металлы

В этом примере СН2-группа помещается вместо связи металл-металл, образуя соединение (29); этот комплекс содержит две плоские квадратные платиновые группировки, связанные мостиком СН2 и фосфиновыми лигандами.
Металлы, находящиеся в правой части d-блока периодической системы, преимущественно существуют в низких степенях окисления и образуют соединения с мягкими лигандами.
9.11. Сульфиды металлов и сульфидные комплексы
Сера—менее электроотрицательный и химически более мягкий элемент, чем кислород, поэтому ей свойствен более широкий диапазон степеней окисления и она проявляет более сильное сродство к «мягким» металлам правой части d-блока. Например, сульфид цинка(II) легко кристаллизуется из раствора, содержащего Zn2+(aq), если к нему добавить водный раствор H2S и NH3 (для регулирования pH), тогда как Sc3+(aq) в этих условиях образует Sc(ОН)3(тв). Ковалентная составляющая энтальпии кристаллической решетки сульфидов «мягких» металлов не может быть скомпенсирована действием воды, поэтому обычно такие сульфиды малорастворимы. Другой отличительной чертой серы является способность образовывать полисульфидные ионы. Вследствие этого в сочетании с ионами щелочных металлов можно получить обширный ряд соединений, содержащих ионы S 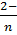 , а небольшие полисульфидные ионы могут быть хелатными лигандами по отношению к ионам d-металлов.
, а небольшие полисульфидные ионы могут быть хелатными лигандами по отношению к ионам d-металлов.
а) Моносульфиды
Моносульфиды, как и монооксиды, характерны для металлов первых рядов d-блока (табл. 9.10). В отличие от монооксидов большинство моносульфидов имеют структуру арсенида никеля (см. рис. 2.15). Однако некоторые относятся к структурному типу NaCl, более характерному для ионной (жесткой) комбинации катиона и аниона. Структурный тип NiAs предпочтительней для более ковалентной (мягкой) комбинации и образуется только тогда, когда есть заметное взаимодействие и соответственно короткое расстояние между атомами металла.
Большинство 3d-металлов образуют моносульфиды, их структура типа NiAs соответствует ковалентному характеру связи.
Металлы d-блока периодической системы
Таблица 9.10. Структуры моносульфидов d-металлов
| Группы | |||||||
| Структура арсенида никеля ( выделены ) | Ti | V | Mn6) | Fe | Co | Ni | |
| Структура каменной соли ( не выделены) | Zr | Nb |
Моносульфиды металлов 6-й группы здесь не показаны; сульфиды более тяжелых металлов имеют более сложное строение.
MnS образует две полиморфные модификации, одна из которых имеет структуру NaCl, а другая — вюртцита.
[Уэллс А. Структурная неограническая химия. В 3-х т. Пер. с англ.— М.: Мир, т. 2, 1987, с. 501]
б) Дисульфиды
Дисульфиды d-металлов подразделяют на два больших класса (табл. 9.11). Один класс включает соединения со слоистой структурой типа СdI2 или MoS2, а другой — соединения с дискретными группами S 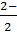 .
.
В структуре слоистых дисульфидов последовательно располагаются слой серы, слой металла и другой слой серы (рис. 9.24). Такие сэндвичи соединены в кристалле через слои серы, так что один слой накладывается на другой. Конечно, такая кристаллическая структура не согласуется с обычной ионной моделью, и ее образование является признаком ковалентности связи между мягким сульфид-ионом и катионом d-металла. Атом металла в такой слоистой структуре окружен шестью атомами серы. Координационное окружение в некоторых случаях октаэдрическое (PtS2), в других — тригонально-призматическое (МоS2)- В структуре MoS2 существует некоторое S—S-связывание, что видно из короткого расстояния между атомами серы внутри двумерных фрагментов MoS2. То, что в большинстве таких соединений реализуется тригональнопризматическое окружение, является разительным контрастом со структурой изолированных комплексов металлов, где наиболее предпочтительно октаэдрическое расположение лигандов.
Таблица 9.11. Структура дисульфидов (MS2) d-металлов
| Группы | ||||||||
| Слоистая ( выделены ) | Ti | Mn | Fe | Co | Ni | Cu | ||
| Пирит или марказит ( не выделены) | Zr | Nb | Mo | Ru | Rh | |||
| Hf | Ta | W | Re | Os | Ir | Pt |
Неуказанные металлы или не образуют дисульфиды, или имеют дисульфиды сложного строения.
[Уэллс А. Структурная неограническая химия. В 3-х т. Пер. с англ.— М.: Мир, т. 2, 1987, с. 505]
Глава 9. Металлы

Рис. 9.24. Структура CdI2, которую имеют Рис. 9.25. Структура пирита FeS2.
многие дисульфиды (в последних вместо
слоев атомов иода располагаются
сульфидные слои).
Некоторые слоистые сульфиды металлов легко вступают в реакции интеркалации, в которых ионы или молекулы проникают внутрь между ближайшими слоями серы; часто одновременно протекает окислительновосстановительная реакция:
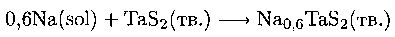
В этой реакции натрий, растворенный в аммиаке (sol), отдает электрон в зону проводимости ТаS2, а ион Na+ проникает в пустоты между слоями серы. Подобные реакции интеркалации характерны для графита (разд. 10.8) и для некоторых оксидов и сульфидов d-элементов (разд. 18.7). Реакции интеркалации между литием и TiS2 исследовались в связи с использованием в легких автомобильных батареях, которые можно быстро перезаряжать, так как твердофазная реакция происходит с незначительными структурными изменениями.
Соединения, содержащие дискретные ионы S 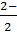 , имеют структуру пирита (рис. 9.25) или марказита. Устойчивость формального иона S
, имеют структуру пирита (рис. 9.25) или марказита. Устойчивость формального иона S 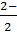 в сульфидах металлов значительно выше, чем иона O
в сульфидах металлов значительно выше, чем иона O 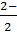 в пероксидах, и соответственно существует намного больше сульфидов, содержащих дисульфид-ион, чем пероксидов.
в пероксидах, и соответственно существует намного больше сульфидов, содержащих дисульфид-ион, чем пероксидов.
4d- и 5d-Металлы, как правило, образуют дисульфиды, построенные из чередующихся слоев ионов серы и ионов металла. Зd-Металлы в степени окисления +2 обычно образуют сульфиды, содержащие дискретные ионы S 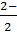 .
.
Пример 9.4. Сопоставление структур двух различных дисульфидов d-элементов.
Сопоставьте структуры MoS2 и FeS2 и объясните их существование, исходя из степеней окисления металлов.
Металлы d-блока периодической системы
Ответ. Сначала нужно решить, устойчивы ли металлы в степени окисления IV так как в этом случае два атома серы будут присутствовать как ионы S2-. Если более устойчива форма М(II), то атомы серы будут находиться в виде частиц S2-, содержащих связь S - S. Поскольку ион S2- является хорошим восстановителем, он может присутствовать вместе только с ионом металла в той степени окисления, которую достаточно трудно восстановить. Как и большинство d-элементов 5-го и 6-го периодов, молибден легко окисляется до Mo(IV), поэтому он может сосуществовать с ионом S2-. Сульфид молибдена(IV) MoS2 имеет слоистую структуру, типичную для дисульфидов металлов. Железо легко окисляется до Fe(II), а не до Fe(IV), поэтому Fe(IV) не может сосуществовать с ионом S2-. Таким образом, наиболее вероятно совместное присутствие Fe(II) и S 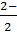 . Минерал FeS2 - пирит, называемый также «ложным золотом» из-за своего вводящего в заблуждение цвета.
. Минерал FeS2 - пирит, называемый также «ложным золотом» из-за своего вводящего в заблуждение цвета.
Вопрос 9.4. Сульфид молибдена(IV) является очень эффективным смазочным материалом. Приведите возможное объяснение этого свойства.
в) Сульфидные комплексы
Координационная химия серо- и кислородсодержащих соединений существенно различается. В основном эти различия связаны со способностью серы к катенации (образованию цепей) и склонностью к взаимодействию с центральным атомом металла в невысокой степени окисления. Исследования кластерных комплексов со связями Fe-S развивались очень активно, так как было обнаружено, что они присутствуют в ферментах, участвующих в переносе электронов и фиксации азота (разд. 19.6)1). Структура одного такого модельного соединения [Fe4S4(SR)4]2- показана на рис. 7.5. Его легко получить из простых исходных веществ в отсутствие воздуха по реакции:

Тот факт, что реакция протекает с участием различных органических групп R, а также хороший выход конечных продуктов указывают на термодинамическую устойчивость каркасной структуры Fe4S4 по сравнению с другими возможными группировками. В этой реакции ион HS- является поставщиком сульфидных лигандов, RS- играет роль как лиганда, так и восстановителя, а СН3О- действует как основание. Кубический кластер содержит атомы Fe и S в противоположных вершинах, так что S является мостиковым атомом для трех атомов Fe. Каждая группа RS- занимает концевые позиции у атомов железа. Кластер остается неизменным при одноэлектронном восстановлении, образуя [Fe4S4(SR)4]3-. Аналогичный кластер участвует в окислительновосстановительных реакциях белка ферредоксина - переносчика электронов.
Cammock R., Sykes A.G.(ed.), Adv. Inorg. Chem., 38 (1992).
Глава 9. Металлы
Простые тиометаллатные комплексы типа [MoS4]2- могут быть легко синтезированы при пропускании газообразного сероводорода через сильнощелочной водный раствор молибдата или вольфрамата:
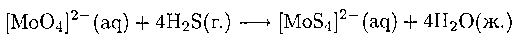
Тетратиометаллатные анионы являются основными исходными продуктами для синтеза комплексов, содержащих несколько металлических атомов. Например, они взаимодействуют со многими двухзарядными ионами металлов, как Со2+ и Zn2+:

Такие полисульфид-ионы, как S  и S
и S  , которые образуются при добавлении элементарной серы к раствору сульфида аммония, также могут играть роль лигандов. Примером является ион [Мо2(S2)6|2- (30), который образуется при взаимодействии полисульфида аммония и МоО
, которые образуются при добавлении элементарной серы к раствору сульфида аммония, также могут играть роль лигандов. Примером является ион [Мо2(S2)6|2- (30), который образуется при взаимодействии полисульфида аммония и МоО  ; он содержит мостиковые лиганды S
; он содержит мостиковые лиганды S  . Более крупные полисульфидные лиганды координируются атомом металла с образованием хелатных колец как в ионе [MoS(S4)2]2- (31), который содержит хелатные лиганды S4.
. Более крупные полисульфидные лиганды координируются атомом металла с образованием хелатных колец как в ионе [MoS(S4)2]2- (31), который содержит хелатные лиганды S4.

Бинарные дисульфиды металлов начала d-блока имеют слоистую структуру, в то время как Fe2+ и многие металлы правой части d-блока образуют дисульфиды, содержащие дискретные ионы S 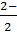 . Для 4d- и 5d-металлов характерны комплексы с хелатными полисульфидными лигандами. Сера преимущественно образует соединения с металлами, находящимися в невысоких степенях окисления.
. Для 4d- и 5d-металлов характерны комплексы с хелатными полисульфидными лигандами. Сера преимущественно образует соединения с металлами, находящимися в невысоких степенях окисления.
ЭЛЕМЕНТЫ 12-Й ГРУППЫ
В этом разделе показано, что закономерности, наблюдаемые для соединений металлов 12-й группы, значительно отличаются от тех, что обсуждались выше для других элементов d-блока. В частности, «благородный характер» (т. е. устойчивость к окислению), усиливающийся вдоль периода для d-элементов, резко уменьшается в 12-й группе. Установлено, что существует связь между легкостью окисления этих металлов и резким уменьшением энергии d-орбиталей в конце d-блока.
Элементы 12-й группы
9.12. Распространенность элементов и получение простых веществ
Цинк — наиболее распространенный элемент 12-й группы. Он находится на двадцать третьем месте по распространенности в земной коре, непосредственно перед медью. Кадмий и ртуть распространены намного меньше, даже меньше большинства лантанидов.
Наиболее важными минералами этих элементов являются сульфиды, причем цинк и кадмий обычно встречаются вместе (табл. 9.12). Сульфид цинка обжигают на воздухе для получения оксида:
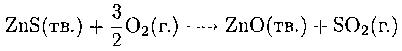
Оксид затем восстанавливают углеродом в шахтных печах. Восстановление происходит в основном монооксидом углерода СО в горячей зоне печи, как это показано на рис. 6.4 для железа. Если кадмий и цинк встречаются вместе, обжиг сульфидной руды на воздухе приводит к образованию смеси оксидов и сульфатов этих металлов. Эту смесь растворяют в серной кислоте и восстанавливают. Разделение основано на более легком восстановлении Cd2+ по сравнению с Zn2+.
Ртуть встречается в природе в виде ярко-красного минерала киновари (HgS), которая одно время использовалась художниками как ярко-красная краска. Однако из-за токсичности ртути в настоящее время HgS в качестве краски не используется. Металлическую ртуть получают обжигом сульфида на воздухе:
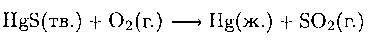
Цинк и ртуть получают из сульфидных минералов окислением сульфида до SO2.
9.13. Окислительно-восстановительные реакции
Цинк и кадмий окисляются намного легче, чем их соседи — медь и серебро. Это различие ярко видно при сравнении стандартных электродных потенциалов, которые для Zn2+ (-0,76 В) и Cd2+ (-0,40 В) меньше, чем для Сu2+ (+0,34 В) и Ag+ (+0,80 В). Причиной различия между этими двумя группами
Таблица 9.12. Основные минералы и методы получения металлов 12-й группы
Металл Основные минералы Метод получения
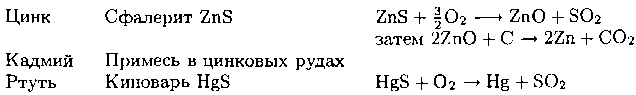
Глава 9. Металлы
является более низкая энтальпия сублимации и, в меньшей степени, уменьшение энтальпии ионизации у элементов 12-й группы по сравнению с элементами 11-й группы:  сублН° = 338 кДж/моль для меди и только 131 кДж/моль для цинка (см. рис. 9.2). Такое уменьшение энтальпии сублимации, в свою очередь, объясняется уменьшением прочности связи металл - металл при переходе от 11-й группы к 12-й. На основании различных данных полагают, что слабость связи металл - металл у элементов 12-й группы определяется незначительным вкладом d-орбиталей в связывание. Уменьшение вклада d - d-связывания коррелирует с понижением энергии d-орбиталей (см. рис. 1.19).
сублН° = 338 кДж/моль для меди и только 131 кДж/моль для цинка (см. рис. 9.2). Такое уменьшение энтальпии сублимации, в свою очередь, объясняется уменьшением прочности связи металл - металл при переходе от 11-й группы к 12-й. На основании различных данных полагают, что слабость связи металл - металл у элементов 12-й группы определяется незначительным вкладом d-орбиталей в связывание. Уменьшение вклада d - d-связывания коррелирует с понижением энергии d-орбиталей (см. рис. 1.19).
Еще одним отличием от других элементов d-блока является заметное изменение в химических свойствах при переходе от самого легкого металла цинка к его соседям по группе - кадмию и ртути. Например, ртуть значительно менее электроположительна, чем цинк и кадмий, и единственная из них имеет соединения со степенью окисления +1 (ион Hg 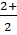 ), существующие в водном растворе. Отчасти как результат такой устойчивости Hg
), существующие в водном растворе. Отчасти как результат такой устойчивости Hg 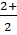 значительно более важная частица, чем редкие и намного легче окисляющиеся Zn
значительно более важная частица, чем редкие и намного легче окисляющиеся Zn 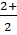 и Cd
и Cd 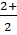 .
.
Химические, спектроскопические и рентгеноструктурные исследования показали, что Hg(I) существует как биядерный катион Hg 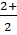 , это был первый пример частицы со связью металл-металл. Значительно позднее был идентифицирован ион Cd
, это был первый пример частицы со связью металл-металл. Значительно позднее был идентифицирован ион Cd 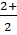 в Cd2(AlCl4)2. Существуют спектроскопические доказательства образования Zn
в Cd2(AlCl4)2. Существуют спектроскопические доказательства образования Zn  при реакции металлического цинка с расплавленным ZnCl2. Cd2(AlCl4)2 - соединение, содержащее ион Cd
при реакции металлического цинка с расплавленным ZnCl2. Cd2(AlCl4)2 - соединение, содержащее ион Cd 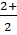 , достаточно хорошо изучено. Необходимым условием его существования является наличие большого аниона, который стабилизирует большой катион. Синтез соединений Cd
, достаточно хорошо изучено. Необходимым условием его существования является наличие большого аниона, который стабилизирует большой катион. Синтез соединений Cd 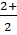 проводят в среде расплавленных солей (строго в отсутствие влаги):
проводят в среде расплавленных солей (строго в отсутствие влаги):

Кадмий(1) быстро диспропорционирует в водной среде:

Протеканию этой реакции способствует существенная энтальпия гидратации иона Cd2+. В случае ртути(1) ситуация не слишком отличается, так как величины констант равновесия реакции диспропорционирования для Cd  и Hg
и Hg 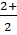 оказываются близкими:
оказываются близкими:

Это равновесие сдвигается вправо под действием веществ, образующих с Hg2+ прочные комплексы или осадки. Например, добавление CN- приводит к появлению устойчивого комплекса Hg(II):
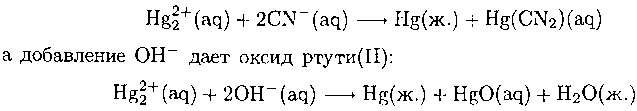
Легкость восстановления катионов металлов 12-й группы уменьшается от Hg2+ к Zn2+.
Металлы d-блока периодической системы
9.14. Координационная химия
Ртуть(II) образует ряд линейных двухкоординациопных комплексов, например: Hg(CN)2, Hg(CH3)2 и O-Hg-O в твердом оксиде ртути(II) HgO. Цинк и кадмий обычно имеют более высокие координационные числа в пределах от 4 до 61). Координация цинка в ZnO -тетраэдрическая, а кадмия в CdO, имеющем структуру типа NaCl, — октаэдрическая. Уменьшение склонности к образованию линейных комплексов, как и более жесткий характер ионов Zn2+ и Cd2+ по сравнению с Сu+ и Ag+ соответственно, может быть следствием большей разницы энергий заполненных d-орбиталей и свободных s- и р-орбиталей, которая характерна для 12-й группы.
Амфотерность соединений элементов 4-го периода в низких степенях окисления увеличивается слева направо вдоль периода, что проиллюстрировано на рис. 5.5. Ион Zn2+ проявляет амфотерные свойства:
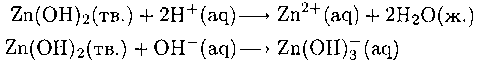
Гидроксид кадмия также взаимодействует с гидроксид-ионом, но для растворения требуется более концентрированная щелочь. Гидроксид ртути(II) не амфотерен.
В соответствии с тем что катионы элементов 12-й группы Zn2+, Cd2+ и Hg2+ имеют полностью заполненный d-подуровень (электронная конфигурация d10), они бесцветны в водных растворах. Однако некоторые из тяжелых галогенидов и халькогенидов окрашены. Например, ZnCl2 и Znl2 оба бесцветны, а у кадмия и ртути не окрашены только хлориды; иодид кадмия — желтый, a Hgl2 имеет две модификации, одна из которых желтая, а другая - красная. Присутствие тяжелых галогенид-ионов приводит к изменению энергии переходов с переносом заряда из ультрафиолетовой области (для неокрашенных соединений) в видимую область спектра. Соединения, окрашенные за счет переходов с переносом заряда, имеют намного более интенсивный цвет, чем соединения с d- d-переходами, поэтому они находят применение в качестве красителей.
Zn(II) и Cd(II) обычно образуют тетраэдрические комплексы; Hg(II) образует линейные комплексы XHgX с лигандами CN- и подобными сильными донорами.
МЕТАЛЛЫ р-БЛОКА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Для сравнения с химическими свойствами других элементов-металлов в этом разделе описаны окислительно-восстановительные свойства соединений и некоторые аспекты комплексообразования металлов p-блока: алюминия, галлия, индия, таллия (группа 13/III), олова, свинца (группа 14/IV) и висмута (группа 15/V). Дополнительная информация об этих элементах приведена в гл. 11 и 12, где они рассматриваются вместе с элементами-неметаллами р-блока.
Главным исключением из этого правила является образование цинком, кадмием и ртутью линейных алкильных соединений MR2 (разд. 15.3).
Глава 9. Металлы
Степень окисления N Степень окисления N
Рис. 9.26. Диаграмма Фроста для Рис. 9.27. Диаграмма Фроста для
p-металлов группы 13/III в кислом р-металлов группы 14/IV в кислом
растворе. растворе.
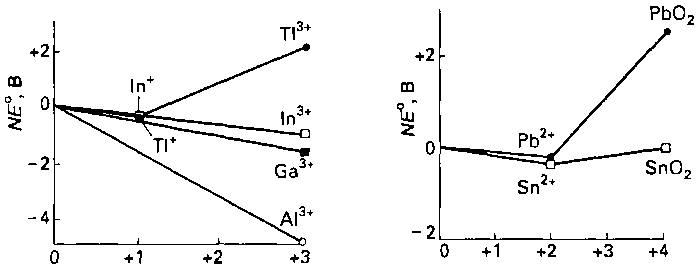
В отличие от d-элементов тяжелые p-металлы существуют преимущественно в низких степенях окисления. Эта закономерность проиллюстрирована на рис. 9.26 для металлов группы 13/III, из рисунка видно, что максимальная степень окисления легче достигается галлием, а не таллием. Для последнего более характерна степень окисления +1. Такое же предпочтение степени окисления на 2 меньше номера группы наблюдается в группах 14/IV (рис. 9.27) и 15/V. В этом проявляется эффект инертной пары. Простого объяснения этого эффекта пока нет: вероятно, лучше всего объяснять его низкими значениями энтальпии связи М—X тяжелых р-металлов и тем фактом, что необходимо меньше энергии для окисления элементов до низшей степени окисления, чем до высшей. Эта энергия должна компенсироваться образованием ионной или ковалентной связи, поэтому высокая степень окисления может быть недоступна, если данный элемент образует слабые связи.
Наиболее характерные степени окисления трех самых тяжелых элементов этих групп — T1(I), Pb(II), Bi(III), а соединения этих элементов в степенях окисления, соответствующих номеру группы — Tl(III), Pb(IV), Bi(V), легко восстанавливаются. Высокая окислительная активность этих элементов в высшей степени окисления также проявляется в том, что их бинарные соединения немногочисленны. Например, соединения типа Т1Х3 существуют для X = F, С1 и Br, a TlI3 состоит из катиона Т1+ и аниона I3. Аналогично для свинца PbF4 известен, РbСl4 не может существовать при температуре выше комнатной, а бромид и иодид свинца (IV) неизвестны.
Для тяжелых металлов р-блока в основном характерны низкие степени окисления.
9.15. Распространенность элементов и получение простых веществ
Распространенность металлов p-блока очень различна: алюминий - третий по распространенности элемент в земной коре (после кислорода и
Металлы d-блока периодической системы
кремния), а висмут является самым тяжелым элементом, имеющим стабильный изотоп. Галлий, который более распространен, чем литий, бор, свинец и многие другие элементы, очень дорог, так как сильно рассеян в алюминий- и железосодержащих минералах. Галлий трудно выделить, поскольку свойства соединений Ga3+, А13+ и Fe3+ очень похожи, это связано с близостью их радиусов и сходством кислотно-основных свойств. Методы получения этих металлов приведены в табл. 9.13. Легкие, наиболее электроположительные металлы алюминий и галлий получают из оксидов. Большие затраты на высокотемпературный электролиз самого активного из них -алюминия (разд. 6.1)-компенсируются распространенностью боксита и экономической эффективностью крупнотоннажного производства.
Из рассматриваемых здесь элементов наименее распространены таллий и висмут. Низкая распространенность этих элементов хорошо согласуется с общей закономерностью уменьшения энергии связи в ядрах при увеличении атомного номера. По причинам, касающимся особенностей структуры ядра, свинец не подчиняется этой закономерности и является более распространенным элементом, чем лантаниды и германий. Так же как ртуть и кадмий, свинец вреден для окружающей среды из-за высокой токсичности. К сожалению, свинец, ртуть и кадмий обладают уникальными свойствами и используются при производстве потребительских товаров от аккумуляторов до электрических выключателей.
Большая часть алюминия на Земле находится в глинах и алюмосиликатах, которые непригодны для получения металла с экономической точки зрения. Основной рудой при производстве алюминия является боксит - гидратированный оксид. Галлий, который присутствует в следовых количествах в боксите, производится как побочный продукт при очистке алюминия. Более тяжелые и химически более мягкие p-металлы группы 13/III (индий и таллий) вместе с германием из группы 14/IV получают как побочный продукт при переработке сульфидных руд более распространенных элементов. Висмут иногда получают из минералов висмутина Вi2S3 или бисмита Вi2S3, но в основном его выделяют, так же как и другие тяжелые p-металлы, при выплавке меди, цинка и свинца.
Таблица 9.13. Основные минералы и методы получения важных в практическом отношении металлов групп 13/III — 15/V
| Металл | Основные минералы | Метод получения |
| Группа 13 | ||
| Алюминий | Боксит Al2O3 xH2O | Электролиз ( процесс холла ) |
| Галлий | Следы в алюминиевых и цинковых рудах | |
| Группа 14 | ||
| Олово | Касситерит SnO2 | SnO2 + C → Sn + CO2 |
| Свинец | Галенит PbS | PbS +  O2 → PbO + SO2
затем 2PbO + C → 2Pb + CO2 O2 → PbO + SO2
затем 2PbO + C → 2Pb + CO2
|
| Группа 15 | ||
| Висмут | Следы в цинковых, медных и свинцовых сульфидных рудах |
Глава 9. Металлы
Среди p-элементов наиболее распространены алюминий и кремний, а наименее - таллий и висмут.
9.16. Металлы группы 13/III
Металлы группы 13/III обладают серебристым блеском; их температуры плавления меняются неравномерно сверху вниз по группе: Аl (660°С), Ga (30°С), In (157°С) и Тl (330°С). Низкая температура плавления галлия связана с необычной структурой этого металла, которая содержит частицы Ga2, сохраняющиеся в расплаве. Галлий, индий и таллий механически очень мягкие металлы.
а) Степень окисления +3, соответствующая номеру группы
Галогениды алюминия и галлия образуются при непосредственном взаимодействии этих металлов с галогеном. Они также могут быть получены по реакции металлов с газообразными НСl или НВr, обычно это более удобный способ получения галогенидов:

Для этой цели в лаборатории часто используют реактор «горячая трубка», один из которых приведен на рис. Д12.1. Галогениды обоих металлов доступны в виде готовых реактивов, но нередко их синтезируют в лаборатории, когда необходимы вещества, не загрязненные продуктами гидролиза.
Из-за маленького радиуса иона F- фториды AlF3 и GaF3 являются твердыми кристаллическими веществами, имеющими намного более высокие температуры плавления и энтальпии сублимации, чем другие галогениды. Большие значения энтальпии кристаллической решетки приводят к тому, что они плохо растворимы в большинстве растворителей и не являются кислотами Льюиса по отношению к простым донорным молекулам. Напротив, более тяжелые галогениды растворимы в различных полярных растворителях и являются отличными кислотами Льюиса. Однако вопреки малой реакционной способности по отношению к большинству доноров AlF3 и GaF3 образуют соли типа Na3AlF6 и Na3GaF6, содержащие октаэдрический комплексный ион [MF6]3-.
Льюисовская кислотность галогенидов согласуется с относительной химической жесткостью элементов группы 13/III. Так, по отношению к жестким основаниям Льюиса (таким, как этилацетат, жесткий за счет донорных атомов О) кислотность ослабевает в соответствии с увеличением мягкости акцептора в следующем порядке:
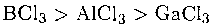
Наоборот, по отношению к мягким основаниям Льюиса (например, диметилсульфиду, мягкому за счет атома S) сила кислот Льюиса возрастает с увеличением мягкости акцептора:

В соответствии с общей закономерностью увеличения координационных чисел для более тяжелых p-элементов галогениды алюминия и его более тяжелых
Металлы d-блока периодической системы
аналогов могут присоединять больше одной молекулы основания Льюиса, при этом атом металла становится гипервалентным:
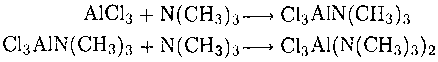
Наиболее устойчивая форма оксида алюминия α-Al2O3. Это очень твердый и тугоплавкий материал. Он известен как минерал корунд и драгоценный камень сапфир. Синий цвет последнего обусловлен переносом заряда между примесными ионами Fe2+ и Ti4+. Структуры a-формы оксида Аl и оксида галлия Gа2О3 представляют собой гексагональную плотнейшую упаковку ионов О2-, в которой ионы металла занимают две трети октаэдрических пустот. Рубин — это α-Аl2O3, в котором небольшая часть ионов Аl3+ замещена ионами Сг3+. В отличие от фиолетового [Сг(Н2O)6]3+ или зеленого Сr2О3 в данном случае Сг(III) обусловливает красный цвет рубина; причина в том, что при замещении маленького иона Аl3+ ион Сг3+ оказывается сжат лигандами О2-. Это сжатие увеличивает параметр расщепления полем лигандов и смещает первую полосу спин-разрешенного d-d-перехода в сторону большей энергии.
Дегидратация гидроксида алюминия при температуре ниже 900°С приводит к образованию τ-Al2O3 - метастабильной поликристаллической формы с очень большой площадью поверхности. Отчасти благодаря наличию поверхностных кислотных и основных центров этот материал используется в качестве твердой фазы в хроматографии и как гетерогенный катализатор или матрица для катализатора (разд. 17.5).
Для бора, алюминия и галлия преобладает степень окисления +3; их тригалогениды являются кислотами Льюиса.
б) Низшие степени окисления галлия, индия и таллия
Алюминий в степени окисления ниже +3 встречается редко. Так, АlСl(г.) известен только при очень высокой температуре, А1+ неустойчив в твердых соединениях. Устойчивость соединений элементов группы 13/III в степени окисления +1 увеличивается вниз по группе, и галлий образует такие вещества, как твердые Gal и Ga(AlCl4). Галогениды Ga(I) и Ga(II) (например, GaCl и GaCb) могут быть получены по реакции сопропорционирования галогенида галлия (III) с металлическим галлием:

Формула GaCl2 не вполне верна, так как это твердое вещество, так же как и большинство других кажущихся двухвалентными солей, не содержит Ga(II). Это соединение со смешанной степенью окисления: Ga(I) и Ga(III). Соединения со смешанной степенью окисления известны также для более тяжелых элементов, а именно InCl2 и ТlВr2. На присутствие М(III) указывает существование в этих солях комплексного иона [МХ4]- с короткими расстояниями М-X, а на присутствие иона М+ - большие расстояния М-X и менее упорядоченное расположение этих ионов металла относительно галогенид-ионов. В действительности существует очень топкая грань между образованием ионных соединений
Глава 9. Металлы
со смешанной степенью окисления и соединений со связью металл-металл. Например, при смешивании GaCl2 с раствором [N(СНз)4]Сl в неводном растворителе образуется соединение [N(СН3)4]2[CI3Gа-СаСl3], в котором анион имеет этаноподобное строение со связью Ga-Ga.
Свойства соединений галлия(I) и индия(I) очень похожи, например, они диспропорционируют при растворении в воде:

С другой стороны, Т1+ стабилен по отношению к диспропорционированию в воде, так как Tl3+ трудно получить из-за эффекта инертной пары, о котором говорилось выше.
Как уже было отмечено, d-элементы в низких степенях окисления являются мягкими кислотами Льюиса, тогда как для тяжелых p-элементов закономерность прямо противоположная. Относительное сродство к мягким и жестким донорам показывает, что ион Тl+ более жесткий, чем Тl3+. Однако в действительности ион Т1+ находится как раз на границе между жесткими и мягкими кислотами. Например, он проникает в клетки вместе с жестким ионом К+. Подобно гидроксидам щелочных металлов, ТlOН растворим в воде, но в отличие от К+ хлорид, бромид и сульфид таллия(1) нерастворимы в воде. Проникновение через стенки клетки и реакции с мягкими донорами, по-видимому, объясняют высокую токсичность таллия для млекопитающих.
Моногалогениды GaX, InX и ТlХ известны для X = Сl, Вr и I. При обычных условиях галогениды таллия (1) - изоляторы, что типично для ионных соединений. Однако при высоких давлениях образуется новая фаза, имеющая заметную электропроводность, которая уменьшается с увеличением температуры. Такое изменение соответствует металлической проводимости (см. введение перед разд. 3.14).
Устойчивость соединений элементов в степени окисления +1 значительно увеличивается при переходе от галлия к таллию.
Пример 9.5. Предсказание реакций галогенидов элементов группы 13/III.
Напишите уравнения химических реакций (или укажите на отсутствие реакции) между: а) АlСl3 и (C2H5)3NGaCl3 в толуоле; б) (C2H5)3NGaCl3 и GaF3 в толуоле; в) ТlСl и NaI в воде.
Ответ, а) А1(III) более сильная и жесткая кислота Льюиса, чем Ga(III), поэтому возможна следующая реакция:
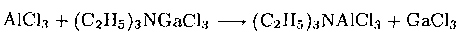
б) Реакция не идет, так как GaF3 имеет очень высокую энтальпию кристаллической решетки и поэтому не является хорошей кислотой Льюиса.
в) Тl(I) является пограничным, но химически мягким, поэтому с анионом I-, более мягким, чем С1-, возможна реакция:
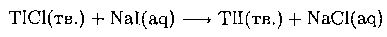
Подобно галогенидам серебра галогениды Т1(1) малорастворимы в воде, поэтому реакция, вероятно, будет идти очень медленно.
Металлы d-блока периодической системы
Вопрос 9.5. Обоснуйте возможность химических реакций и приведите их уравнения для следующих пар: a) (CH3)2SAlCl3 и GaBr3; б) ТlСl3 и формальдегид (СН2O) в кислом водном растворе. (Подсказка: формальдегид легко окисляется до СO2 и Н+.)
9.17. Олово и свинец
Водные и неводные растворы солей олова(II) часто используют как мягкие восстановители, однако они должны храниться в инертной атмосфере, так как на воздухе быстро окисляются:

Известны все ди- и тетрагалогениды олова. Среди тетрагалогенидов хлорид, бромид и иодид - молекулярные соединения, а тетрафторид имеет строение, соответствующее ионным твердым веществам, поскольку маленький ион F- позволяет образовать шестикоординационную структуру. Тетрафторид свинца также имеет структуру, характерную для ионных соединений, тогда как PbCl4, в соответствии с эффектом инертной пары, неустойчив и при комнатной температуре разлагается на PbCl2 и Cl2. Тетрабромид и тетраиодид свинца неизвестны, так что в химии галогенидов свинца преобладают дигалогениды. Окружение центрального атома олова и свинца атомами галогенов в дигалоге- нидах обычно отклоняется от правильного тетраэдра или октаэдра из-за присутствия стереохимически активной свободной электронной пары. Искажение структуры больше проявляется в случае маленького иона F-, менее искаженная структура наблюдается в случае более крупных галогенид-ионов.
Олово в обеих степенях окисления, Sn(II) и Sn(IV), образует многочисленные комплексы. Так, SnCl4 образует в кислых растворах комплексные ионы [SnCl5]‑ и [SnCl6]2-. В неводных растворах различные доноры взаимодействуют с SnCl4 как умеренно сильной кислотой Льюиса, образуя комплексы, подобные цис-SnCl4(ОРМе3)2-. Тригалогенидные комплексы Sn(II) типа [SnCl3] получаются в водных и неводных растворах. Их пирамидальная структура свидетельствует о наличии свободной электронной пары (32). Ион [SnCl3]- может служить в качестве мягкого донора для ионов d-металлов; один из необычных примеров - красный кластер состава Pt3Sn8Cl20, имеющий тригонально-бипирамидальное строение (33).
Оксиды свинца очень интересны как с научной, так и с практической точки зрения. В красной форме PbO ион Pb(II) имеет КЧ 4 (рис. 9.28), причем ионы О2-, окружающие ион свинца, образуют квадрат. Как и в случае галогенидов, эту структуру можно объяснить, используя наличие стереохимически активной неподеленной электронной пары на атоме металла. Свинец также образует оксиды со смешанной степенью окисления металла. Наиболее известен Pb3O4 свинцовый сурик, который содержит Pb(IV) в октаэдрическом и Pb(II) в несимметричном шестикоординационном окружении. Предположение о различной степени окисления свинца в этих двух положениях основано на более коротких расстояниях РЬ-О для атома, идентифицированного как Pb(IV). Коричневая форма оксида свинца(IV) PbO2 кристаллизуется в структурном типе рутила.
Глава 9. Металлы

Этот оксид является компонентом катода свинцовых аккумуляторов (дополнение 9.2).
Для олова и свинца характерны степени окисления +2 и +4, однако Pb(IV) - хороший окислитель, поэтому его тетрахлорид неустойчив, а тетрабромид и тетраиодид неизвестны. Sn(II) имеет неподеленную стереохимически активную электронную пару, поэтому его тригалогенидные анионы имеют пирамидальное строение и могут служить лигандами для мягких металлических центров.
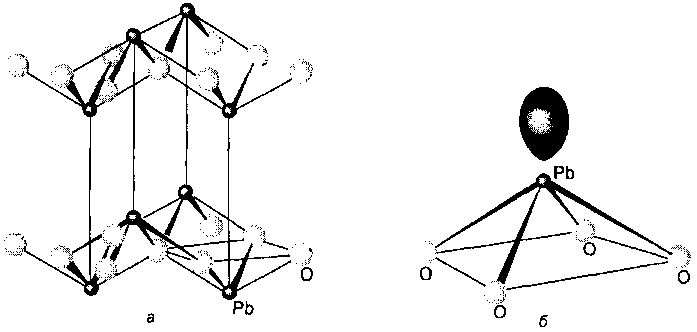
Рис. 9.28. Структура РЬО (а) и квадратно-пирамидальный фрагмент (б), демонстрирующий возможную ориентацию стереохимически активной неподеленной электронной пары.
Дополнение 9.2. Свинцовые кислотные аккумуляторы
Свинцовые кислотные аккумуляторы являются наиболее удачным видом перезаряжаемых гальванических элементов. Их химия интересна тем, что показывает роль и кинетики, и термодинамики в процессах, происходящих в ячейках.
Металлы d-блока периодической системы
В полностью заряженном состоянии активным материалом катода является РЬO2, а анода - свинец; электролит представляет собой разбавленную серную кислоту. Особенность этого процесса состоит в том, что содежащие свинец исходные вещества и продукты реакции на обоих электродах нерастворимы. Во время работы ячейки (когда вырабатывается электрический ток) на катоде идет реакция восстановления Pb(IV) из РbO2 до Pb(II), который в присутствии серной кислоты осаждается на электроде в виде
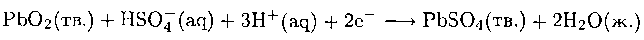
На аноде свинец окисляется до Pb(II), который также осаждается в виде сульфата:

Полностью реакцию можно записать так:
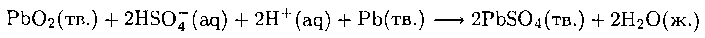
Разность потенциалов (приблизительно 2 В) удивительно высока для ячейки, в которой используется водный электролит, и значительно превышает потенциал окисления воды до O2 (1,23 В). Работа аккумулятора обусловлена высоким перенапряжением (и следовательно, низкой скоростью) окисления Н2O на РЬO2 и восстановления воды на свинце.
9.18. Висмут
Химические свойства висмута поразительным образом иллюстрируют эффект инертной пары. Например, Bi с большим трудом отдает для связывания все пять валентных электронов, большинство соединений висмута содержат Bi(III). Ион Bi3+ может считаться пограничным между мягкими и жесткими катионами. Подтверждением этих свойств является то, что Bi(OH)3 и Bi2S3 нерастворимы в воде. Приблизительные значения стандартных электродных потенциалов в кислых водных растворах показывают высокую окислительную способность соединений висмута со степенью окисления +5 и слабый электроположительный характер металла:
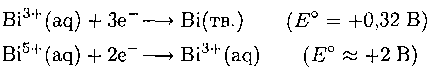
Соединения висмута(V) получают нагреванием оксида Вi2O3 с пероксидом натрия:

При растворении висмутата натрия в водном растворе кислоты, не дающей комплексы, например НСlO4, образуется метастабильная, недостаточно изученная частица, содержащая Bi(V). В приведенной выше полуреакции она обозначена как Bi5+, на самом деле это может быть [Вi(ОН)6]-.
Глава 9. Металлы
Координационная химия висмута(III) отражает его пограничные свойства, т. е. способность взаимодействовать с мягкими и жесткими лигандами, а также склонность к образованию искаженного координационного окружения. В действительности строение обычно согласуется с моделью ОЭПВО, а искажение геометрии, ожидаемой на основании химической формулы, является результатом присутствия стереохимически активной неподеленной электронной пары. Существование такого «искажения» структуры закономерно для соединений p-элементов в низких степенях окисления и уже обсуждалось для Pb(II) и Sn(II). Таким образом:
1. При низких координационных числах существует искажение в строении. Например, в соответствии с моделью ОЭПВО BiF3 в газовой фазе имеет пирамидальное строение.
2. Более сильное искажение структуры наблюдается в соединениях легких металлов p-блока. Действительно, соединения Sb(III) чаще демонстрируют отклонение от плоских структур, чем соединения Bi(III).
3. Маленькие лиганды способствуют искажению структуры. Так, фторидные или алкокси-лиганды непременно приводят к этому. Например, алкоксид висмута с эмпирической формулой Вi(OC2H4OCH3) в твердом состоянии имеет цепочечное строение с алкоксидными мостиками и квадратнопирамидальным окружением висмута (34). Аналогично анионный комплекс [Bi2Cl8]2- имеет квадратно-пирамидальную координацию каждого атома висмута (35)
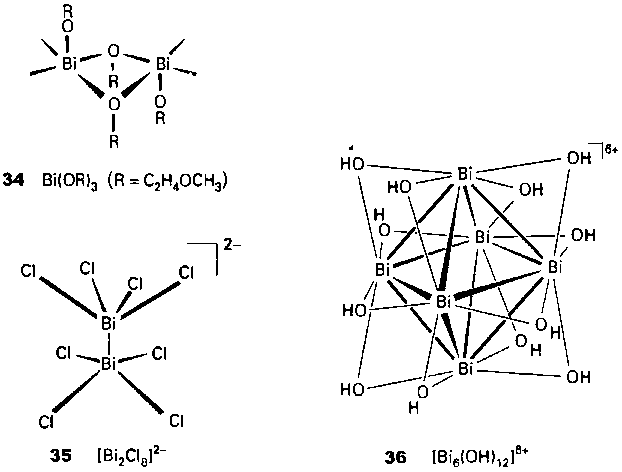
1) Matchett М. A., Chang М. Y., Buh.ro W. Е., «Soluble and volatile alkoxides of bismuth», Inorg. Chem., 29, 359 (1990).
Металлы d-блока периодической системы
Интересно отметить, что Bi(III) образует в кислых водных растворах гидроксокомплекс [Вi6(ОН)12]6+, который представляет собой октаэдр из атомов висмута, связанных мостиковыми группами ОН- по каждому ребру октаэдра (36).
Существует три структурных фактора, способствующих искажению в строении соединений, а именно: низкое координационное число, легкий р-элемент в качестве центрального атома и маленькие лиганды.
МЕТАЛЛЫ ƒ-БЛОКА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ
Каждый ряд из пятнадцати элементов ƒ-блока соответствует заполнению семи 4ƒ- и 5ƒ-орбиталей с ƒ° до ƒ14. Свойства 4ƒ-элемеитов лантанидов — чрезвычайно похожи, в то время как химия 5ƒ-элементов — актинидов — очень разнообразна. В общем случае лантаниды обозначаются Ln, а актиниды — Аn.
9.19. Распространенность элементов и получение простых веществ
Не считая прометия, который не имеет стабильных изотопов, наименее распространенный лантанид – тулий подобен иоду по распространенности в земной коре. Основным минеральным источником легких лантанидов является монацит, содержащий смесь лантанидов и тория (Ln,Th)PO4 Другой фосфатный минерал, ксенотим — основной источник иттрия и тяжелых лантанидов1).
Таблица 9.14. Названия, символы и свойства лантанидов
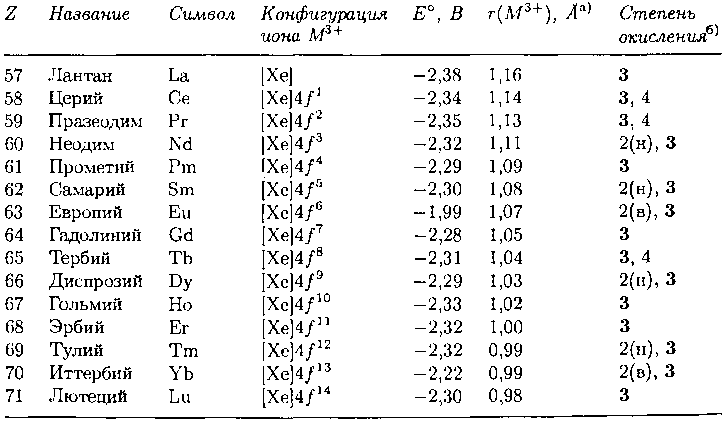
Ионные радиусы для КЧ 8 из [Shannon R.D., Acta Crystallogr., А32, 751, 1976].
Выделены шрифтом наиболее устойчивые степени окисления; другие могут быть реализованы в водных (в) или неводных (н) растворах.
Глава 9. Металлы
Таблица 9.15. Названия, символы и свойства актинидов
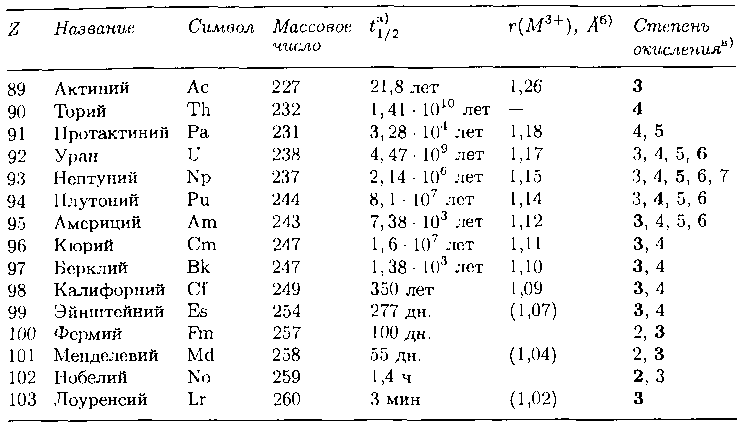
Период полураспада наиболее долгоживущего изотопа.
б) Ионные радиусы для КЧ 6 из [Shannon R. D., Acta Crystallogr., А32, 751 (1976)]. Оценочные значения в скобках из [Briichle W. et al, Inorg. Chim. Acta, 146, 267 (1988)].
в) Степени окисления в водных растворах, основная степень окисления выделена шрифтом [Seaborg G.T., Loveland W. D., The elements beyond uranium. Willey Interscience, New York, 1990, p. 84].
Основная степень окисления лантанидов +3 (табл. 9.14). Способность церия окисляться до Ce(IV), а европия – восстанавливаться до Eu(II) может служить основой химического способа отделения этих металлов от других лантанидов. Разделение оставшихся лантанидов при многотоннажном производстве осуществляется многократной жидкостной экстракцией, при которой ионы распределяются между водной фазой и органической, содержащей комплексообразующий реагент. Для достижения высокой чистоты разделяемых лантанидов используют метод ионообменной хроматографии, который детально описан ниже в этом разделе. Чистые лантаниды, а также их смесь получают электролизом расплава их галогенидов.
Сплав легких лантанидов, содержащий церий, в промышленности известен как мишметалл. Он используется в производстве стали для удаления таких примесей, как кислород, водород, сера и мышьяк, которые уменьшают механическую прочность и ковкость стали.
После висмута (Z = 83) не существует элементов, имеющих стабильные изотопы, но у двух актинидов – тория (Th, Z = 90) и урана (U, Z — 92) – есть долгоживущие изотопы, которые в заметных количествах встречаются в
1) Хотя, строго говоря, иттрий не является лантанидом, по радиусу и химическим свойствам он похож на тяжелые лантаниды
Металлы d-блока периодической системы
природе (табл. 9.15). Остальные актиниды более радиоактивны, чем торий и уран. Их получают путем ядерных реакций. Главная руда урана – уранинит (урановая смолка) – имеет приблизительный состав UO2. В настоящее время уран в основном используется в ядерных реакторах электростанций, которых сейчас сотни по всему миру.
Основным источником лантанидов является фосфатный минерал монацит, наиболее важный из актинидов – уран – получают из уранинита.
9.20. Лантаниды
Лантаниды – это семейство высокоэлектроположительных элементов, находящихся в 6-м периоде между s- и p-блоками1). Иногда их называют редкими землями, однако это неподходящее название, так как они не особенно редки, за исключением прометия, не имеющего стабильных изотопов. У лантанидов впервые наблюдается заполнение ƒ-орбиталей в электронной конфигурации атома в основном состоянии. Химические свойства лантанидов очень похожи, что отличает их от d-элементов, свойства которых в пределах каждого ряда значительно различаются.
Для элементов от La до Yb характерна степень окисления +3, такое постоянство беспрецедентно в периодической системе. Возможно, это связано с высокой чувствительностью 4ƒ-электронов к заряду вне внутренней оболочки атома, и, если он превышает +3, 4ƒ-электроны становятся связаны слишком прочно, чтобы вообще участвовать в химических реакциях. Следует отметить, что различные свойства элементов, непосредственно связанные со степенью окисления, меняются весьма значительно. Например, радиусы ионов М3+ (табл. 9.14) сильно уменьшаются от 1,16 А у La3+ до 0,98 А у Lu3+, это уменьшение радиусов на 15% приводит к большому увеличению энтальпии гидратации вдоль ряда. Более детальный анализ показывает, что за счет удачной комбинации энтальпий сублимации, сольватации и ионизации в цикле Борна-Габера для образования акваиона стандартный электродный потенциал восстановления иона La3+ до металла (-2,38 В) близок к значению для Lu3+ (-2,30 В), находящегося на другом конце
Дата добавления: 2015-05-30; просмотров: 2845;
