Тангенциальная составляющая ускорения 12 страница
 (63.3)
(63.3)
получаем
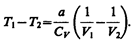
Так как V2> V1, то Т1 > Т2, т. е. реальный газ при адиабатическом расширении в вакуум охлаждается. При адиабатическом сжатии в вакуум реальный газ нагревается.
§ 64. Эффект Джоуля — Томсона
Если идеальный газ адиабатически расширяется и совершает при этом работу, то он охлаждается, так как работа в данном случае совершается за счет его внутренней энергии (см. § 55). Подобный процесс, но с реальным газом — адиабатическое расширение реального газа с совершением внешними силами положительной работы—осуществили английские физики Дж. Джоуль (1818—1889) и У. Томсон (лорд Кельвин, 1824—1907).
Рассмотрим эффект Джоуля — Томсона. На рис. 93 представлена схема их опыта. В теплоизолированной трубке с пористой перегородкой находятся два поршня, которые могут перемешаться без трения. Пусть сначала слева от перегородки газ под поршнем 1 находится под давлением р1, занимает объем V1 при температуре Т1, а справа газ отсутствует (поршень 2 придвинут к перегородке). После прохождения газа через пористую перегородку в правой части газ характеризуется параметрами р2, V2, T2. Давления p1 и p2 поддерживаются постоянными (p1>p2).
Так как расширение газа происходит без теплообмена с окружающей средой (адиабатически), то на основании первого начала термодинамики
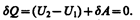 (64.1)
(64.1)
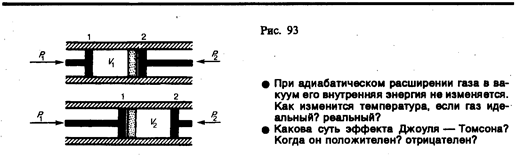
Внешняя работа, совершаемая газом, состоит из положительной работы при движении поршня 2 (А2=р2V2) и отрицательной при движении поршня 1 (A1=p1V1), т. е. dA=A2—A1. Подставляя выражения для работ в формулу (64.1), получаем
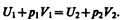 (64.2)
(64.2)
Таким образом, в опыте Джоуля — Томсона сохраняется (остается неизменной) величина U+pV. Она является функцией состояния и называется энтальпией.
Ради простоты рассмотрим 1 моль газа. Подставляя в формулу (64.2) выражение (63.3) и рассчитанные из уравнения Ван-дер-Ваальса (61.2) значения p1V2и р2V2 (символ «m» опять опускаем) и производя элементарные преобразования, получаем
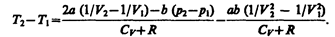 (64.3)
(64.3)
Из выражения (64.3) следует, что знак разности (T2—T1) зависит от того, какая из поправок Ван-дер-Ваальса играет бóльшую роль. Проанализируем данное выражение, сделав допущение, что p2<<p1 и V2>>V1:
1) а »0 — не учитываем силы притяжения между молекулами, а учитываем лишь размеры самих молекул. Тогда
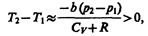
т. е. газ в данном случае нагревается;
2) b »0 — не учитываем размеров молекул, а учитываем лишь силы притяжения между молекулами. Тогда
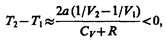
т. е. газ в данном случае охлаждается;
3) учитываем обе поправки. Подставив в выражение (64.3) вычисленное из уравнения Ван-дер-Ваальса (61.2) значение р1, имеем
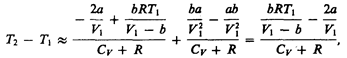 (64.4)
(64.4)
т. е. знак разности температур зависит от значений начального объема V1 и начальной температуры Т1.
Изменение температуры реального газа в результате его адиабатического расширения, или, как говорят,адиабатического дросселирования — медленного прохождения газа под действием перепада давления сквозьдроссель (например, пористую перегородку), называетсяэффектом Джоуля—Томсона. Эффект Джоуля — Томсона принято называтьположительным, если газ в процессе дросселирования охлаждается (DT<0), иотрицательным, если газ нагревается (DT > 0).
В зависимости от условий дросселирования для одного и того же газа эффект Джоуля — Томсона может быть как положительным, так и отрицательным. Температура, при которой (для данного давления) происходит изменение знака эффекта Джоуля — Томсона, называетсятемпературой инверсии. Ее зависимость от объема получим, приравняв выражение (64.4) нулю:
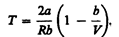 (64.5)
(64.5)
Кривая, определяемая уравнением (64.5), — кривая инверсии — приведена на рис. 94. Область выше этой кривой соответствует отрицательному эффекту Джоуля — Томсона, ниже — положительному. Отметим, что при больших перепадах давления на дросселе температура газа изменяется значительно. Так, при дросселировании от 20 да 0,1 МПа и начальной температуре 17° С воздух охлаждается на 35° С.
Эффект Джоуля — Томсона обусловлен отклонением газа от идеальности. В самом деле, для моля идеального газа рVm=RТ, поэтому выражение (64.2) примет вид
откуда следует, что Т1 = T2.
§ 65. Сжижение газов
Превращение любого газа в жидкость — сжижение газа — возможно лишь при температуре ниже критической (см. § 62). При ранних попытках сжижения газов оказалось, что некоторые газы (Cl, СО2, NH3) легко сжижались изотермическим сжатием, а целый ряд газов (O2, N2, H2, He) сжижению не поддавался. Подобные неудачные попытки объяснил Д. И. Менделеев, показавший, что сжижение этих газов производилось при температуре, большей критической, и поэтому заранее было обречено на неудачу. Впоследствии удалось получить жидкий кислород, азот и водород (их критические температуры равны соответственно 154,4, 126,1 и 33 К), а в 1908 г. нидерландский физик Г. Камерлинг-Оннес (1853—1926) добился сжижения гелия, имеющего самую низкую критическую температуру (5,3 К).
Для сжижения газов чаще применяются два промышленных метода, в основе которых используется либо эффект Джоуля—Томсона, либо охлаждение газа при совершении им работы.
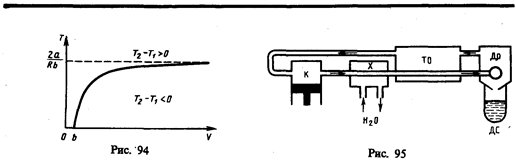
Схема одной из установок, в которой используется эффект Джоуля—Томсона, —машины Линде* — представлена на рис. 95. Воздух в компрессоре (К) сжимается до давления в десятки мегапаскаль и охлаждается в холодильнике (X) до температуры ниже температуры инверсии, в результате чего при дальнейшем расширении газа наблюдается положительный эффект Джоуля — Томсона (охлаждение газа при его расширении). Затем сжатый воздух проходит по внутренней трубе теплообменника (ТО) и пропускается через дроссель (Др), при этом он сильно расширяется и охлаждается. Расширившийся воздух вновь засасывается по внешней трубе теплообменника, охлаждая вторую порцию сжатого воздуха, текущего по внутренней трубе. Так как каждая следующая порция воздуха предварительно охлаждается, а затем пропускается через дроссель, то температура понижается все больше. В результате 6—8-часового цикла часть воздуха (»5%), охлаждаясь до температуры ниже критической, сжижается и поступает в дьюаровский сосуд (ДС) (см. § 49), а остальная его часть возвращается в теплообменник.
* К. Линде (1842—1934) — немецкий физик и инженер.
Второй метод сжижения газов основан на охлаждении газа при совершении им работы. Сжатый газ, поступая в поршневую машину (детадер), расширяется и совершает при этом работу по передвижению поршня. Taк как работа совершается за счет внутренней энергии газа, то его температура при этом понижается.
Академик П. Л. Капица предложил вместо детандера применять турбодетандер, в котором газ, сжатый всего лишь до 500—600 кПа, охлаждается, совершая работу по вращению турбины. Этот метод успешно применен Капицей для сжижения гелия, предварительное охлаждение которого производилось жидким азотом. Современные мощные холодильные установки работают по принципу турбодетандера.
§ 66. Свойства жидкостей. Поверхностное натяжение
Жидкость является агрегатным состоянием вещества, промежуточным между газообразным и твердым, поэтому она обладает свойствами какгазообразных, так и твердых веществ. Жидкости, подобно твердым телам, обладают определенным объемом, а подобно газам, принимают форму сосуда, в котором они находятся (см. § 28). Молекулы газа практически не связаны между собой силами межмолекулярного взаимодействия, и в данном случае средняя энергия теплового движения молекул газа гораздо больше средней потенциальной энергии, обусловленной силами притяжения между ними (см. § 60), поэтому молекулы газа разлетаются в разные стороны и газ занимает предоставленный ему объем. В твердых и жидких телах силы притяжения между молекулами уже существенны и удерживают молекулы на определенном расстоянии друг от друга. В этом случае средняя энергия хаотического (теплового) движения молекул меньше средней потенциальной энергии, обусловленной силами межмолекулярного взаимодействия, и ее недостаточно для преодоления сил притяжения между молекулами, поэтому твердые тела и жидкости имеют определенный объем.
Рентгеноструктурный анализ жидкостей показал, что характер расположения частиц жидкости промежуточен между газом и твердым телом. В газах молекулы движутся хаотично, поэтому нет никакой закономерности в их взаимном расположении. Для твердых тел наблюдается так называемый дальний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на больших расстояниях. В жидкостях имеет место так называемый ближний порядок в расположении частиц, т. е. их упорядоченное расположение, повторяющееся на расстояниях, сравнимых с межатомными.
Теория жидкости до настоящего времени полностью не развита. Разработка ряда проблем в исследовании сложных свойств жидкости принадлежит Я. И. Френкелю (1894—1952). Тепловое движение в жидкости он объяснял тем, что каждая молекула в течение некоторого времени колеблется около определенного положения равновесия, после чего скачком переходит в новое положение, отстоящее от исходного на расстоянии порядка межатомного. Таким образом, молекулы жидкости довольно медленно перемещаются по всей массе жидкости и диффузия происходит гораздо медленнее, чем в газах. С повышением температуры жидкости частота колебательного движения резко увеличивается, возрастает подвижность молекул, что, в свою очередь, является причиной уменьшения вязкости жидкости.
На каждую молекулу жидкости со стороны окружающих молекул действуют силы притяжения, быстро убывающие с расстоянием (см. рис. 88); следовательно, начиная с некоторого минимального расстояния силами притяжения между молекулами можно пренебречь. Это расстояние (порядка 10–9 м) называется радиусом молекулярного действияr, а сфера радиуса r — сферой молекулярного действия.
Выделим внутри жидкости какую-либо молекулу А (рис. 96) и проведем вокруг нее сферу радиуса r. Достаточно, согласно определению, учесть действие на данную молекулу только тех молекул, которые находятся внутри сферы молекулярного действия. Силы, с которыми эти молекулы действуют на молекулу А, направлены в разные стороны и в среднем скомпенсированы, поэтому результирующая сила, действующая на молекулу внутри жидкости со стороны других молекул, равна нулю. Иначе обстоит дело, если молекула, например молекула В, расположена от поверхности на расстоянии, меньшем r. В данном случае сфера молекулярного действия лишь частично расположена внутри жидкости. Так как концентрация молекул в расположенном над жидкостью газе мала по сравнению с их концентрацией в жидкости, то равнодействующая сил F, приложенных к каждой молекуле поверхностного слоя, не равна нулю и направлена внутрь жидкости. Таким образом, результирующие силы всех молекул поверхностного слоя оказывают на жидкость давление, называемоемолекулярным(иливнутренним). Молекулярное давление не действует на тело, помещенное в жидкость, так как оно обусловлено силами, действующими только между молекулами самой жидкости.
Суммарная энергия частиц жидкости складывается из энергии их хаотического (теплового) движения и потенциальной энергии, обусловленной силами межмолекулярного взаимодействия. Для перемещения молекулы из глубины жидкости в поверхностный слой надо затратить работу. Эта работа совершается за счет кинетической энергии молекул и идет на увеличение их потенциальной энергии. Поэтому молекулы поверхностного слоя жидкости обладают большей потенциальной энергией, чем молекулы внутри жидкости. Эта дополнительная энергия, которой обладают молекулы в поверхностном слое жидкости, называемая поверхностной энергией, пропорциональна площади слоя DS:
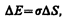 (66.1)
(66.1)
где s — поверхностное натяжение.
Так как равновесное состояние характеризуется минимумом потенциальной энергии, то жидкость при отсутствии внешних сил будет принимать такую форму, чтобы при заданном объеме она имела минимальную поверхность, т. е. форму шара. Наблюдая мельчайшие капельки, взвешенные в воздухе, можем видеть, что они действительно имеют форму шариков, но несколько искаженную из-за действия сил земного тяготения. В условиях невесомости капля любой жидкости (независимо от ее размеров) имеет сферическую форму, что доказано экспериментально на космических кораблях.
Итак, условием устойчивого равновесия жидкости является минимум поверхностной энергии. Это означает, что жидкость при заданном объеме должна иметь наименьшую площадь поверхности, т. е. жидкость стремится сократить площадь свободной поверхности. В этом случае поверхностный слой жидкости можно уподобить растянутой упругой пленке, в которой действуют силы натяжения.
Рассмотрим поверхность жидкости (рис. 97), ограниченную замкнутым контуром. Под действием сил поверхностного натяжения (направлены по касательной к поверхности жидкости и перпендикулярно участку контура, на который они действуют) поверхность жидкости сократилась и рассматриваемый контур переместился в положение, отмеченное светло-серым цветом. Силы, действующие со стороны выделенного участка на граничащие с ним участки, совершают работу
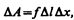
где f — сила поверхностного натяжения, действующая на единицу длины контура поверхности жидкости.
Из рис. 97 видно, что DlDx = DS, т. е.
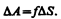 (66.2)
(66.2)
Эта работа совершается за счет уменьшения поверхностной энергии, т. е.
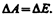 (66.3)
(66.3)
Из сравнения выражений (66.1) — (66.3) видно, что
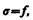 (66.4)
(66.4)
т. е. поверхностное натяжение s равно силе поверхностного натяжения, приходящейся на единицу длины контура, ограничивающего поверхность. Единица поверхностного натяжения — ньютон на метр (Н/м) или джоуль на квадратный метр (Дж/м2) (см. (66.4) и (бб.1)). Большинство жидкостей при температуре 300 К имеет поверхностное натяжение порядка 10–2—10–1 Н/м. Поверхностное натяжение с повышением температуры уменьшается, так как увеличиваются средние расстояния между молекулами жидкости.
Поверхностное натяжение существенным образом зависит от примесей, имеющихся в жидкостях. Вещества, ослабляющие поверхностное натяжение жидкости, называются пoвеpxностно-активными. Наиболее известным поверхностно-активным веществом по отношению х воде является мыло. Оно сильно уменьшает ее поверхностное натяжение (примерно с 7,5 •10–2 до 4,5 • 10–2 Н/м). Поверхностно-активными веществами, понижающими поверхностное натяжение воды, являются также спирты, эфиры, нефть и др.
Существуют вещества (сахар, соль), которые увеличивают поверхностное натяжение жидкости благодаря тому, что их молекулы взаимодействуют с молекулами жидкости сильнее, чем молекулы жидкости между собой. Например, если посолить мыльный раствор, то в поверхностный слой жидкости выталкивается молекул мыла больше, чем в пресной воде. В мыловаренной технике мыло «высаливается» этим способом из раствора.
§ 67. Смачивание
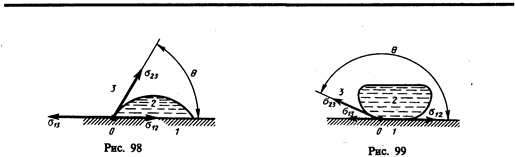
Из практики известно, что капля воды растекается на стекле и принимает форму, изображенную на рис. 98, в то время как ртуть на той же поверхности превращается в несколько сплюснутую каплю (рис. 99). В первом случае говорят, что жидкость смачивает твердую поверхность, во втором — не смачивает ее. Смачивание зависит от характера сил, действующих между молекулами поверхностных слоев соприкасающихся сред. Для смачивающей жидкости силы притяжения между молекулами жидкости и твердого тела больше, чем между молекулами самой жидкости, и жидкость стремится увеличить поверхность соприкосновения с твердым телом. Для несмачивающей жидкости силы притяжения между молекулами жидкости и твердого тела меньше, чем между молекулами жидкости, и жидкость стремится уменьшить поверхность своего соприкосновения с твердым телом.
К линии соприкосновения трех сред (точка О есть ее пересечение с плоскостью чертежа) приложены три силы поверхностного натяжения, которые направлены по касательной внутрь поверхности соприкосновения соответствующих двух сред (рис. 98 и 99). Эти силы, отнесенные к единице длины линии соприкосновения, равны соответствующим поверхностным натяжениям s12, s13, s23. Угол q между касательными к поверхности жидкости и твердого тела называется краевым углом. Условием равновесия капли (рис. 98) является равенство нулю суммы проекций сил поверхностного натяжения на направление касательной к поверхности твердого тела, т. е.
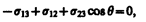
откуда
 (67.1)
(67.1)
Из условия (67.1) вытекает, что краевой угол может быть острым или тупым в зависимости от значений s13 и s12. Если s13 > s12, то cosq > 0 и угол q—острый (рис. 98), т. е. жидкость смачивает твердую поверхность. Если s13 < s12, то cosq < 0 и угол q — тупой (рис. 99), т. е. жидкость не смачивает твердую поверхность. Краевой угол удовлетворяет условию (67.1), если
 (67.2)
(67.2)
Если условие (67.2) не выполняется, то капля жидкости 2 ни при каких значениях q не может находиться в равновесии. Если s13 > s12 + s23, то жидкость растекается по поверхности твердого тела, покрывая его тонкой пленкой (например, керосин на поверхности стекла), —имеет место полное смачивание (в данном случае q = 0). Если s12 > s13 + s23, то жидкость стягивается в шаровую каплю, в пределе имея с ней лишь одну точку соприкосновения (например, капля воды на поверхности парафина), — имеет место полное несмачивание (в данном случае q = p).
Смачивание и несмачивание являются понятиями относительными, т. е. жидкость, смачивающая одну твердую поверхность, не смачивает другую. Например, вода смачивает стекло, но не смачивает парафин; ртуть не смачивает стекло, но смачивает чистые поверхности металлов.
Явления смачивания и несмачивания имеют большое значение в технике. Например, в методе флотационного обогащения руды (отделение руды от пустой породы) ее, мелко раздробленную, взбалтывают в жидкости, смачивающей пустую породу и не смачивающей руду. Через эту смесь продувается воздух, а затем она отстаивается. При этом смоченные жидкостью частицы породы опускаются на дно, а крупинки минералов «прилипают» к пузырькам воздуха и всплывают на поверхность жидкости. При механической обработке металлов их смачивают специальными жидкостями, что облегчает и ускоряет обработку.
§ 68. Давление под искривленной поверхностью жидкости
Если поверхность жидкости не плоская, а искривленная, то она оказывает на жидкость избыточное (добавочное) давление. Это давление, обусловленное силами поверхностного натяжения, для выпуклой поверхности положительно, а для вогнутой поверхности — отрицательно.
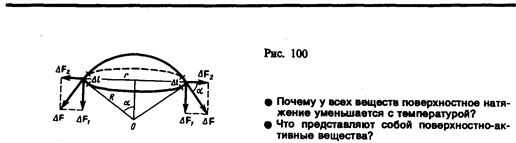
Для расчета избыточного давления предположим, что свободная поверхность жидкости имеет форму сферы радиуса R, от которой мысленно отсечен шаровой сегмент, опирающийся на окружность радиуса r=Rsina (рис. 100). На каждый бесконечно малый элемент длины Dl этого контура действует сила поверхностного натяжения DF = s Dl, касательная к поверхности сферы. Разложив DF на два компонента (DF1 и DF2), видим, что геометрическая сумма сил DF2 равна нулю, так как эти силы на противоположных сторонах контура направлены в обратные стороны и взаимно уравновешиваются. Поэтому равнодействующая сил поверхностного натяжения, действующих на вырезанный сегмент, направлена перпендикулярно плоскости сечения внутрь жидкости и равна алгебраической сумме составляющих DF1:
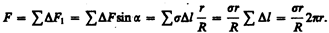
Разделив эту силу на площадь основания сегмента pr2, вычислим избыточное давление на жидкость, создаваемое силами поверхностного натяжения и обусловленное кривизной поверхности:
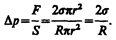 (68.1)
(68.1)
Если поверхность жидкости вогнутая, то можно доказать, что результирующая сила поверхностного натяжения направлена из жидкости и равна
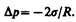 (68.2)
(68.2)
Следовательно, давление внутри жидкости под вогнутой поверхностью меньше, чем в газе, на величину Dp.
Формулы (68.1) и (68.2) являются частным случаем формулы Лапласа,* определяющей избыточное давление для произвольной поверхности жидкости двоякой кривизны:
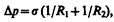 (68.3)
(68.3)
где R1 и R2 — радиусы кривизны двух любых взаимно перпендикулярных нормальных сечений поверхности жидкости в дайной точке. Радиус кривизны положителен, если центр кривизны соответствующего сечения находится внутри жидкости, и отрицателен, если центр кривизны находится вне жидкости.
*П. Лаплас (1749—1827) — французский ученый.
Для сферической искривленной поверхности (R1=R2=R) выражение (68.3) переходит в (68.1), для цилиндрической (R1=R и R2=¥) — избыточное давление
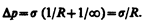
В случае плоской поверхности (R1=R2=¥) силы поверхностного натяжения избыточного давления не создают.
§ 69. Капиллярные явления
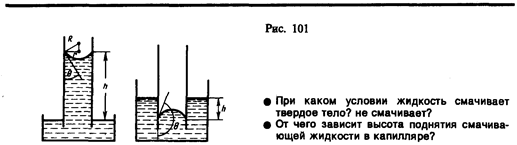
Если поместить узкую трубку(капилляр) одним концом в жидкость, налитую в широкий сосуд, то вследствие смачивания или несмачивания жидкостью стенок капилляра кривизна поверхности жидкости в капилляре становится значительной. Если жидкость смачивает материал трубки, то внутри ее поверхность жидкости —мениск — имеет вогнутую форму, если не смачивает — выпуклую (рис. 101).
Под вогнутой поверхностью жидкости появится отрицательное избыточное давление, определяемое по формуле (68.2). Наличие этого давления приводит к тому, что жидкость в капилляре поднимается, таккак под плоской поверхностью жидкости в широком сосуде избыточного давления нет. Если же жидкость не смачивает стенки капилляра, то положительное избыточное давление приведет к опусканию жидкости в капилляре. Явление изменения высоты уровня жидкости в капиллярах называется капиллярностью. Жидкость в капилляре поднимается или опускается на такую высоту h, при которой давление столба жидкости (гидростатическое давление) rgh уравновешивается избыточным давлением Dp, т. е.
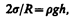
где r — плотность жидкости, g — ускорение свободного падения.
Если r — радиус капилляра, q — краевой угол, то из рис. 101 следует, что (2s cosq)/r = rgh, откуда
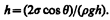 (69.1)
(69.1)
В соответствии с тем, что смачивающая жидкость по капилляру поднимается, а несмачивающая—опускается, из формулы (69.1) при q<p/2 (cosq>0) получим положительные значения h, а при q>p/2 (cosq<0) — отрицательные. Из выражения (69.1) видно также, что высота поднятия (опускания) жидкости в капилляре обратно пропорциональна его радиусу. В тонких капиллярах жидкость поднимается достаточно высоко. Так, при полном смачивании (q=0) вода (r =1000 кг/м3, s = 0,073 Н/м) в капилляре диаметром 10мкм поднимается на высоту h »3 м.
Капиллярные явления играют большую роль в природа и технике. Например, влагообмен в почве и в растениях осуществляется за счет поднятия воды по тончайшим капиллярам. На капиллярности основано действие фитилей, впитывание влаги бетоном и т. д.
§ 70. Твердые тела. Моно- и поликристаллы
Твердые тела (кристаллы) характеризуются наличием значительных сил межмолекулярного взаимодействия и сохраняют постоянными не только свой объем, но и форму. Кристаллы имеют правильную геометрическую форму, которая, как показали рентгенографические исследования немецкого физика-теоретика М. Лауэ (1879—1960), является результатом упорядоченного расположения частиц (атомов, молекул, ионов), составляющих кристалл. Структура, для которой характерно регулярное расположение частиц с периодической повторяемостью в трех измерениях, называется кристаллической решеткой. Точки, в которых расположены частицы, а точнее — средние равновесные положения, около которых частицы совершают колебания, называются узлами кристаллической решетки.
Кристаллические тела можно разделить на две группы: монокристаллы и поликристаллы. Монокристаллы — твердые тела, частицы которых образуют единую кристаллическую решетку. Кристаллическая структура монокристаллов обнаруживается по их внешней форме. Хотя внешняя форма монокристаллов одного типа может быть различной, но углы между соответствующими гранями у них остаются постоянными. Это закон постоянства углов, сформулированный М. В. Ломоносовым. Он сделал важный вывод, что правильная форма кристаллов связана с закономерным размещением частиц, образующих кристалл. Монокристаллами являются большинство минералов. Однако крупные природные монокристаллы встречаются довольно редко (например, лед, поваренная соль, исландский шпат). В настоящее время многие монокристаллы выращиваются искусственно. Условия роста крупных монокристаллов (чистый раствор, медленное охлаждение и т. д.) часто не выдерживаются, поэтому большинство твердых тел имеет мелкокристаллическую структуру, т. е. состоит из множества беспорядочно ориентированных мелких кристаллических зерен. Такие твердые тела называются поликристаллами (многие горные породы, металлы и сплавы).
Характерной особенностью монокристаллов является их анизотропность, т. е. зависимость физических свойств — упругих, механических, тепловых, электрических, магнитных, оптических — от направления. Анизотропия монокристаллов объясняется тем, что в кристаллической решетке различно число частиц, приходящихся на одинаковые по длине, но разные по направлению отрезки (рис. 102), т. е. плотность расположения частиц кристаллической решетки по разным направлениям неодинакова, что и приводит к различию свойств кристалла вдоль этих направлений. В поликристаллах анизотропия наблюдается только для отдельных мелких кристалликов, но их различная ориентация приводит к тому, что свойства поликристалла по всем направлениям в среднем одинаковы.
Дата добавления: 2015-05-28; просмотров: 654;
