Параметры состояния воды и водяного пара
Вследствие незначительной сжимаемости воды можно принять, что плотность воды при 0° С и любых давлениях есть величина постоянная, (u'0= 0,001 м3/кг). Начало отсчета внутренней энергии энтальпии и энтропии берется от 0° Си соответствующего давления насыщения р = 0,00610 бар. При этих параметрах энтальпия, энтропия, а также внутренняя энергия воды берутся условно равными нулю: s'0 = 0, i'0 = 0, u'0 = 0.
В процессе подогрева воды происходит нагревание ее до температуры кипения tн. Удельный объем воды при температуре кипения u'будет больше объема u'0. Соответствующие значения u'для воды в функции температуры и давления для состояний, лежащих или на нижней пограничной кривой, или левее ее, даются в справочной литературе.
Количество теплоты, которое нужно сообщать воде, чтобы нагреть ее от 0° С до температуры кипения в процессе р = const, называется теплотой жидкости. Это количество теплоты определяется по формуле
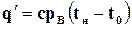 , (11.15)
, (11.15)
или
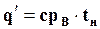 (11.16)
(11.16)
где 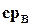 – средняя теплоемкость воды в интервале температур от 0° С до tН°С/
– средняя теплоемкость воды в интервале температур от 0° С до tН°С/
При низких по сравнению с Ткртемпературах можно считать 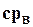 = 4,1865 кДж/(кг·град).
= 4,1865 кДж/(кг·град).
Воспользуемся в изобарном процессе подогрева воды первым законом термодинамики, по которому
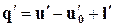 (11.17)
(11.17)
где u'— внутренняя энергия воды при температуре кипения.
Так как при 0° С u¢0 = 0, а работа расширения жидкости
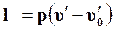 (11.18)
(11.18)
практически заметна только при больших значениях давления, то
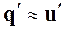 (11.19)
(11.19)
Энтальпия воды при температуре кипения определяется по общей формуле
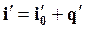 (11.20)
(11.20)
Полагая, что 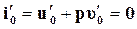 , получим
, получим
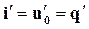 (11.21)
(11.21)
В процессе нагревания жидкости от 0° С до температуры кипения происходит увеличение ее энтропии, которое может быть найдено по формуле
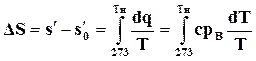 (11.22)
(11.22)
при s'0 = 0 и сРв = 4,1865 кДж/(кг·град)
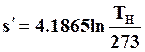 (11.23)
(11.23)
В процессе парообразования жидкость, нагретая до температуры кипения при этой температуре и определенном постоянном давлении, обращается в пар. Количество теплоты, затрачиваемое в процессе при р = const на превращение 1 кг воды при температуре кипения в сухой насыщенный пар той же температуры, обозначим через r.
Теплота rназывается скрытой теплотой парообразования. По первому закону термодинамики
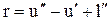 (11.24)
(11.24)
где u²— внутренняя энергия сухого насыщенного пара;
l" — работа расширения в процессе парообразования.
Разность внутренних энергий u" – u¢ затрачиваемая на работу против внутренних сил, называется внутренней теплотой парообразованияи обозначается буквой r. Теплота, затрачиваемая на работу против внешних сил, равна
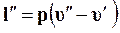 (11.25)
(11.25)
и называется внешней теплотой парообразования. Обозначим ее буквой y.
Таким образом,
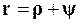 (11.26)
(11.26)
Вследствие того, что процесс парообразования идет при постоянном давлении,
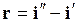 (11.27)
(11.27)
Величиныr и i"даются в таблицах насыщенного пара, а 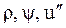 - легко определяются по приведенным выше формулам.
- легко определяются по приведенным выше формулам.
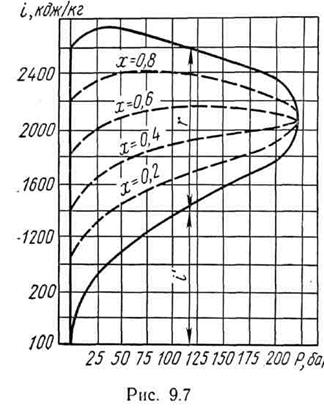
С возрастанием давления, как видно из рисунка 11.7, увеличивается энтальпия жидкости и достигает максимального значения при критическом давлении. Скрытая теплота парообразования уменьшается с ростом давления и равна нулю при критическом давлении (и температуре), потому что в этих условиях различия между жидкостью и ее паром исчезают и процесс парообразования как таковой отсутствует.
Изменение энтропии в процессе парообразования при подведении к кипящей воде r кДж/кгтеплоты равно
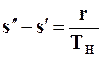 (11.28)
(11.28)
откуда
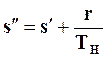 (11.29)
(11.29)
или, используя значение s¢ из выражения (11.23),
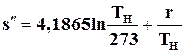 (11.30)
(11.30)
|
При полном испарении жидкости состояние сухого насыщенного пара определяется одним параметром: давлением или температурой. Поэтому объем, внутренняя энергия и энтальпия определяются по таблицам насыщенного пара по давлению или температуре.
Связь между удельными объемами жидкости и пара на линии насыщения u¢ и u² давлением насыщенного пара рНтемпературой ТНи скрытой теплотой парообразования может быть получена следующим образом. При превращении жидкости в пар давление насыщенного пара от объема системы не зависит, следовательно, в выражении 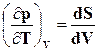 , но так как равновесное превращение жидкости в пар происходит при постоянной температуре (ТН=const), то
, но так как равновесное превращение жидкости в пар происходит при постоянной температуре (ТН=const), то
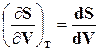 ,
,
где dVпредставляет изменение объема системы при переходе жидкости в пар. Таким образом,
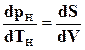 (11.31)
(11.31)
Изменение объема системы, если испарилась жидкость массой dm, равно
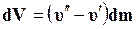 ,
,
а приращение энтропии в квазистатическом процессе испарения жидкости массой dmпо (11.28)
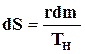 .
.
Подставив эти значения в уравнение (11.31), получим
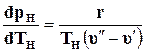 , (11.32)
, (11.32)
где 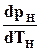 — производная от давления по температуре на кривой фазового равновесия рН = f (TН).
— производная от давления по температуре на кривой фазового равновесия рН = f (TН).
Уравнение (9.32) называют уравнением Клапейрона – Клаузиусаи применяют при исследованиях изменений агрегатного состояния вещества из жидкого состояния в парообразное. Аналогичные уравнения можно применять и к процессам перехода вещества из твердого состояния в жидкое или газообразное.
Параметры влажного насыщенного пара при заданной величине сухости могут быть определены из следующих соотношений.
Удельный объем влажного насыщенного пара
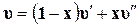 (11.33)
(11.33)
Так как объем воды (1 — х) 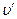 мал по сравнению с объемом пара, то при невысоких давлениях
мал по сравнению с объемом пара, то при невысоких давлениях
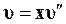 . (11.34)
. (11.34)
Энтальпия влажного насыщенного пара с учетом того, что на превращение в пар х кгжидкости необходимо затратить хr кДж/кгтеплоты, равна
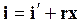 . (11.35)
. (11.35)
Энтропия влажного насыщенного пара
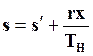 . (11.36)
. (11.36)
Свойства перегретого пара резко отличаются от свойств насыщенного пара и приближаются к свойствам газов.
Перегретый пар характеризуется тем, что его температура выше температуры парообразования ТH при том же давлении и удельный объем его больше, чем объем сухого насыщенного пара при том же давлении.
Количество теплоты, необходимое для перевода 1 кгсухого насыщенного пара при р = const в перегретый с температурой t, называют теплотой перегреваqпи определяют по формуле
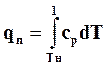 . (11.37)
. (11.37)
Если срm– средняя массовая теплоемкость перегретого пара при постоянном давлении, то
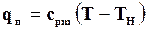 . (11.38)
. (11.38)
Значение срmберется для перегретого пара по формуле 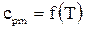 .
.
Энтальпия перегретого пара
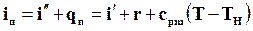 (11.39)
(11.39)
называется полной теплотой перегретого пара. По первому закону термодинамики
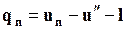 , (11.40)
, (11.40)
где 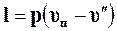 – работа расширения в изобарном процессе перегрева пара;
– работа расширения в изобарном процессе перегрева пара;
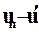 — изменение внутренней энергии в процессе перегрева.
— изменение внутренней энергии в процессе перегрева.
Изменение энтропии в равновесном изобарном процессе перегрева равно
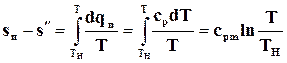 (11.41)
(11.41)
или
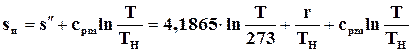 . (11.42)
. (11.42)
Свойства перегретых паров будут тем ближе к свойствам идеального газа, чем больше температура перегрева.
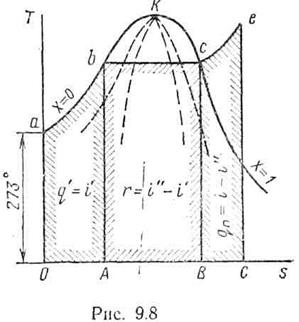
11.2.5 Т–s-диаграмма водяного пара
Для графического изображения процессов, происходящих в паре, удобно пользоваться Т–s - диаграммой, Площадь под кривой обратимого процесса дает количество теплоты, сообщаемое телу или отнимаемое от него. Точкам р–  диаграммы соответствуют определенные точки, Т–sдиаграммы (рисунок 11.8).
диаграммы соответствуют определенные точки, Т–sдиаграммы (рисунок 11.8).
|
Если было принято условно, что энтропия начального состояния воды s0 = 0, то эта точка лежит на оси ординат на 273° выше абсолютного нуля.
Перенося по точкам нижнюю пограничную кривую (х = 0) из системы р–vв Т–s-диаграмму, получим соответствующую ей кривую, абсциссами которой являются значенияs'. Аналогично наносится верхняя пограничная кривая (х=1), абсциссами которой будут значения энтропии сухого насыщенного пара s".
В точке b диаграммы начинается кипение при ТH = const, и энтропия в процессе парообразования повышается
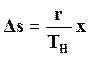 .
.
Процесс парообразования заканчивается в точке с, где
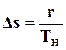 .
.
Так как процесс парообразования идет при Тн = const и р – =const, изотерма b-с является одновременно и изобарой. Дальнейший подвод теплоты снова сопровождается увеличением температуры и энтропии. В процессе перегрева пара (кривая с-е)
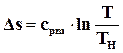 .
.
Вследствие того, что площади в Т-s-диаграмме изображают количество подведенной (отведенной) теплоты, то пл. аbАО– теплота в процессе нагрева жидкости от 0° С до температуры кипения; пл. abСВ– теплота, подводимая к воде в процессе парообразования; пл. сеСВ– теплота, затраченная на перегрев пара.
Учитывая, что количество теплоты в процессе р = const равно разности энтальпий 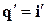 , площадь, ограниченная ординатами, осью абсцисс и изобарой, проходящей через точку, определяет энтальпию в данной точке. Точка пересечения верхней и нижней пограничных кривых является критической точкой К. Область, лежащая между кривыми аКи сK, это область влажного насыщенного пара. Область, лежащая правее верхней пограничной кривой, – область перегретого пара.
, площадь, ограниченная ординатами, осью абсцисс и изобарой, проходящей через точку, определяет энтальпию в данной точке. Точка пересечения верхней и нижней пограничных кривых является критической точкой К. Область, лежащая между кривыми аКи сK, это область влажного насыщенного пара. Область, лежащая правее верхней пограничной кривой, – область перегретого пара.
11.2.6 i–s-диаграмма водяного пара
Для изучения и расчетов различных термодинамических процессов, в которых рабочим телом является насыщенный и перегретый пар, удобна i–s-диаграмма (рисунок 11.9).
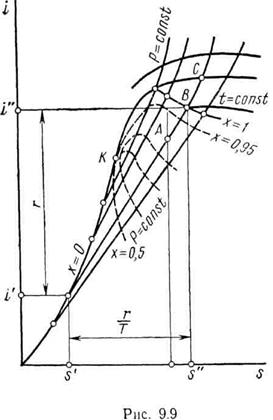
|
В системе координат i–sнаносятся пограничные кривые, изобары и изотермы. Нижняя пограничная кривая и верхняя пограничная кривая строятся по известным значениям 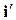 ,
, 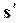 ,
, 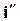 ,
, 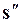 и сливаются в критической точке К. В области влажного насыщенного пара наносятся линии постоянной сухости (пунктирные кривые). В этой диаграмме теплоты жидкостей, парообразование и перегрев изображаются линейными отрезками, а не площадями. Теплота парообразования по данной изобаре
и сливаются в критической точке К. В области влажного насыщенного пара наносятся линии постоянной сухости (пунктирные кривые). В этой диаграмме теплоты жидкостей, парообразование и перегрев изображаются линейными отрезками, а не площадями. Теплота парообразования по данной изобаре
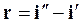
равна разности ординат точек пересечения изобары с правой и левой пограничными кривыми.
Для процесса парообразования, происходящего при р = const,
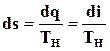 , то есть
, то есть 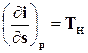 .
.
Следовательно, в области влажного насыщенного пара изобары, являясь одновременно и изотермами, представляют собой прямые линии с угловым коэффициентом, равным Tн.
Изобары пересекают пограничные кривые без излома. Изобары и изохоры в области перегрева – слабо вогнутые логарифмические кривые. Изотермы в области перегретого пара – выпуклые кривые, поднимающиеся слева вверх направо. Чем больше температура, тем выше располагается изотерма. Чем дальше от пограничной кривой (х = 1) проходит изотерма, тем больше она приближается к горизонтали i = const, так как в области идеального газа энтальпия однозначно определяется температурой.
На рисунке 11.9 точки A, В, Сизображают соответственно состояния влажного, сухого и перегретого пара. Точка Алежит на пересечении изобары (изотермы) и линии постоянной сухости. Точка Влежит на пересечении изобары и верхней пограничной кривой. Точка Снаходится на пересечении изобары и изотермы. По положению точки, соответствующей некоторому состоянию пара, можно определить на i–s-диаграмме числовые значения всех параметров в этой точке.
Дата добавления: 2015-04-05; просмотров: 4337;
