Электролиз растворов и расплавов солей (на примере хлорида натрия). Практическое значение электролиза.
Совокупность химических реакций, которые протекают на электродах в растворах или расплавах при пропускании через них электрического тока, называется электролизом.
Указанную совокупность реакций принято подразделять на первичные и вторичные процессы. Первичные процессы — окислительно-восстановительные реакции, протекающие на электродах и ведущие, как правило, к образованию электрически нейтральных активных молекулярных или атомных частиц. Вторичные процессы — реакции взаимодействия активных частиц, образовавшихся в первичных процессах, со средой. Например, при электролизе раствора сульфата натрия протекают следующие электродные реакции:
Первичные реакции
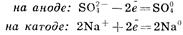
Вторичные реакции
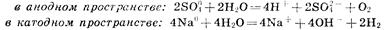
Приведенная совокупность химических реакций может быть представлена суммарным процессом:
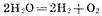
Из этого примера видно, что при электролизе, как и при работе химического источника тока, на аноде происходят процессы окисления, а на катоде — восстановления. При этом анод заряжен положительно (+), а катод — отрицательно (—). Отметим, что при работе химического источника тока, напротив, анод заряжается отрицательно, а катод — положительно, поскольку в этом случае протекают процессы, обратные электролизу.
При электролизе как на аноде, так и на катоде могут происходить конкурирующие процессы.
При проведении электролиза с использованием инертного (нерасходуемого) анода (например, графита), как правило, конкурирующими являются два окислительных и два восстановительных процесса:
на аноде — окисление анионов и гидроксид-ионов
на катоде — восстановление катионов и ионов водорода
При проведении электролиза с использованием активного (расходуемого) анода процесс усложняется и конкурирующими реакциями на электродах являются следующие:
на аноде — окисление анионов и гидроксид-ионов;
анодное растворение металла — материала анода
на катоде — восстановление катиона соли и ионов водорода;
восстановление катионов металла, полученных при растворении анода
При выборе наиболее вероятного процесса на аноде и катоде следует исходить из положения, что будет протекать та реакция, для которой требуется наименьшая затрата энергии. Кроме того, для выбора наиболее вероятного процесса на аноде и катоде при электролизе растворов солей с нерасходуемым электродом используют следующие правила.
1. На аноде могут образовываться следующие продукты: а) при окислении анионов 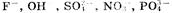 выделяется кислород; б) при окислении анионов
выделяется кислород; б) при окислении анионов 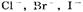 выделяются соответственно хлор, бром, иод; в) при окислении анконов органических кислот происходит процесс:
выделяются соответственно хлор, бром, иод; в) при окислении анконов органических кислот происходит процесс: 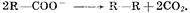
2. Если конкурирующими процессами на катоде является восстановление катионов (металл стоит в электрохимическом ряду напряжений металлов левее водорода) и ионов водорода, то при этом выделяется водород.
В тех случаях, когда в процессе электролиза используется активный (расходуемый) анод, то последний будет окисляться в ходе электролиза и переходить в раствор в виде катионов. Энергия электрического тока при этом расходуется ка перенос металла с анода на катод. Данный процесс широко используется при рафинировании (очистка) металлов. Так, на этом принципе основано, в частности, получение чистой меди из загрязненной. В раствор медного купороса погружают пластины из очищенной и неочищенной меди. Пластины соединяют с источником постоянного тока таким образом, чтобы первая из них (очищенная медь) была отрицательным электродом (катод), а вторая — положительным (анод). В результате пластина из неочищенной меди растворяется и ионы меди из раствора осаждаются на катоде. При этом примесь остается в растворе или оседает на дно ванны. Этот же принцип используется для защиты металлов от коррозии путем нанесения на защищаемое изделие тонких слоев хрома или никеля.
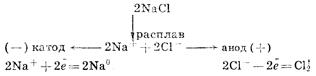
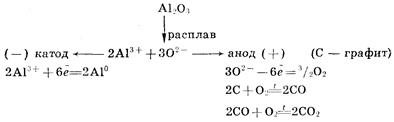
Для получения высокоактивных металлов (натрия, алюминия, магния, кальция и др.), легко вступающих во взаимодействие с водой, применяют электролиз расплава солей:
Зависимость количества вещества, образовавшегося под действием электрического тока, от времени, силы тока и природы электролита может быть установлена на основании обобщенного закона Фа-радея:
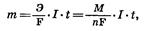
где m — масса образовавшегося при электролизе i-вещества (г); Э — эквивалентная масса i-вещества (г/моль); М — молярная масса i-вещества (г/моль); n — заряд i-иона; I — сила тока (A); t — продолжительность процесса; F — константа Фарадея, характеризующая количество электричества, необходимое для выделения 1 эквивалентной массы вещества (F = 96 500 К = 26,8 А•ч).
Дата добавления: 2015-04-05; просмотров: 2652;
