И концентрации в газовой фазе
| Параметр | х | |||||||
| 0,002 | 0,005 | 0,01 | 0,015 | 0,02 | 0,025 | 0,03 | 0,035 | |
| t, °С | 21,5 | 26,4 | 28,9 | 31,4 | 33,9 | 35,3 | ||
| H, кПа | 80,64 | 87,71 | 96,51 | 141,3 | 170,6 | |||
| p,* Па | 159,6 | |||||||
| y* | 0,0009 | 0,0025 | 0,0057 | 0,0097 | 0,0147 | 0,0212 | 0,0284 | 0,037 |
Данные табл. 17 показывают, что равновесная концентрация аммиака в газовой фазе, соответствующая его концентрации в жидкой фазе 0,002 равна 0,0009, т.е. меньше действительной конечной концентрации Yк = 0,0016. Это свидетельствует о том, что процесс абсорбции аммиака не достигает равновесия, т.е. даже в конце процесса абсорбции движущая сила не равна нулю
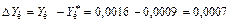 .
.
Движущая сила в начале процесса абсорбции
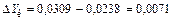 .
.
Средняя движущая сила процесса
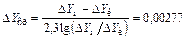 .
.
Пример 2.Определить размеры насадочного скруббера для улавливания HCl из отбросных газов, если расход газа Q0 равен 3600 м3/ч при нормальных условиях, содержание паров HCl в газе y1 равно 10 об.% требуемая степень очистки составляет 90%, температура газа равна 50ºС, скруббер работает при атмосферном давлении P = 101,3 кПа.
Решение. 1. Принимаем для абсорбции противоточный насадочный скруббер с одним слоем насадки в виде керамических колец с размерами 50  50
50 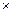 5 мм, правильно уложенных.
5 мм, правильно уложенных.
Определяем концентрацию y2 и парциальное давление хлористого водорода на выходе из насадочного скруббера p2
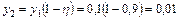 ;
;
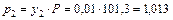 кПа.
кПа.
2. Принимаем в качестве поглотителя 10%-ный раствор Na2CO3. Так как поглощение HCl сопровождается химической реакцией, а количество карбоната натрия находится в избытке, то концентрация HCl в растворе близка к нулю и равновесная концентрация в газе и равновесное парциальное давление тоже близки к нулю. Движущая сила процесса абсорбции на выходе газа из абсорбера Δ 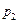 равна
равна
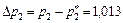 кПа;
кПа;
на входе газа в абсорбер Δ 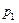

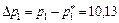 кПа.
кПа.
Средняя движущая сила процесса рассчитывается как среднее логарифмическое
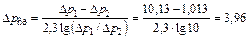 кПа.
кПа.
3. Определяем количество HCl, которое поглощается в процессе абсорбции
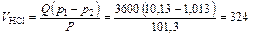 м3/ч;
м3/ч;
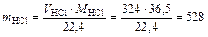 кг/ч.
кг/ч.
4. Определяем расход газа при рабочих условиях
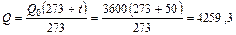 м3/ч или 1,183 м3/с.
м3/ч или 1,183 м3/с.
5. Определяем необходимую площадь сечения скруббера, задавая скорость газа в сечении скруббера w = 1м/с,
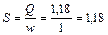 м2.
м2.
Рассчитываем диаметр скруббера
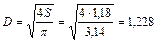 м.
м.
Принимаем ближайший нормализованный диаметр D = 1,2 м и уточняем скорость газа в расчете на все сечение скруббера
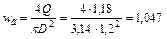 м/с.
м/с.
6. Основные параметры выбранной насадки (см.табл.14): свободное сечение s0 = 0,735; удельная поверхность a = 110 м2/м3; эквивалентный диаметр 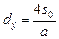 = 27 мм = 0,027 м.
= 27 мм = 0,027 м.
Вычисляем скорость газа в свободном сечении насадки w
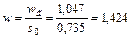 м/с.
м/с.
7. Пользуясь номограммой (рис.68) определяем коэффициент массопередачи, при температуре 50ºС и скорости газа в свободном сечении 1,42 м/с K = 0,48 г/(м2·ч·Па).
8. Определяем необходимую поверхность массопередачи
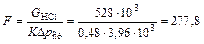 м2.
м2.
9. Находим объем насадки
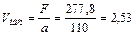 м3.
м3.
10. Вычисляем высоту слоя насадки h
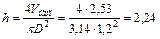 м.
м.
11. Принимаем плотность орошения ρн, м3/ч на 1 м2 поверхности насадки 0,15a, тогда расход жидкости L
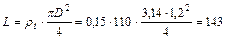 м3/ч.
м3/ч.
Пример 3.Определить размеры аппарата с неподвижным слоем адсорбента для поглощения бензола из воздуха. Концентрация Y бензола в воздухе составляет 0,02 кг/кг, расход воздуха равен 0,8 м3/с, плотность воздуха ρ = 1,2 кг/м3, время защитного действия слоя высотой 1,1 м составляет 1 ч. Адсорбент – активный уголь с насыпной плотностью
ρн = 550 кг/м3.
Решение. 1. Определяем объемную концентрацию бензола C0 в воздухе
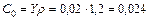 кг/м3.
кг/м3.
2. Находим количество поглощенного до проскока бензола
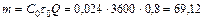 кг.
кг.
3. Определяем необходимую площадь сечения скруббера, задаваясь скоростью в расчете на все сечение аппарата w0 = 0,15м/с,
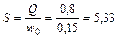 м2.
м2.
4. Вычисляем диаметр скруббера
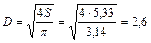 м.
м.
5. Рассчитываем объем адсорбента
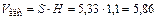 м3.
м3.
5. Определяем массу адсорбента
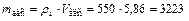 кг.
кг.
6. Рассчитываем величину динамической активности адсорбента
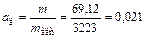 кг/кг.
кг/кг.
Пример 4. При термическом разложении NO в присутствии природного газа температура в реакторе равна 1000ºС, расход газа составляет 20 000 м3/ч, концентрация оксида азота в газе равна 0,32%. Определить степень и скорость разложения оксида азота и необходимый объем реактора.
Решение. 1. Степень разложения оксида азота определяем по уравнению (109)
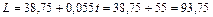 %.
%.
2. Рассчитываем скорость разложения по формуле (110)
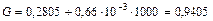 кмоль/м3.
кмоль/м3.
3. Находим необходимый объем реактора
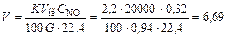 м3.
м3.
Тесты
1. Процесс поглощения газообразных загрязняющих веществ жидкостью называется:
1) адсорбцией; 2) катализом; 3) абсорбцией; 4) десорбцией; 5) конденсацией.
2. Для поглощения диоксида серы из воздуха методом хемосорбции целесообразно использовать раствор:
1) NaCl; 2) Ca(OH)2; 3) CaCl2; 4) KNO3.
3. К абсорбционным аппаратам с непрерывным контактом относятся:
1) полые скрубберы; 2) тарельчатые колонны; 3) многопольные мокрые электрофильтры; 4) многополочные пенные аппараты.
4. Для какого из приведенных газов можно использовать в качестве метода очистки физическую абсорбцию водой:
1) оксид углерода; 2) оксид азота; 3) метан; 4) диоксид углерода;
5) хлористый водород.
5. Количество адсорбата, удерживаемое на единичной площади поверхности раздела фаз, называется:
1) адсорбционной способностью; 2) удельной поверхностью; 3) эквивалентным диаметром; 4) динамической активностью.
6. Режим работы тарельчатого абсорбера, при котором жидкость захватывается выходящим из отверстий газом, называется:
1) барботажным; 2) инжекционным; 3) неравномерным; 4) пенным.
7. Для улавливания органических веществ во влажных газовых потоках наиболее подходит такой адсорбент как:
1) активированный уголь; 2) цеолит; 3) силикагель; 4) активный оксид алюминия.
8. При высокотемпературном восстановлении оксидов азота в качестве восстановителя можно использовать:
1) воздух; 2) хлор; 3) аммиак; 4) диоксид углерода.
9. Методом термического окисления можно обезвредить:
1) формальдегид; 2) диоксид серы; 3) оксид азота; 4) хлористый водород.
10. Недостатком диффузионных горелок при сжигании газообразных отходов является:
1) низкая производительность; 2) высокий расход топлива; 3) неустойчивость газового факела; 4) неполное окисление примесей при высоких избытках воздуха.
11. Преимуществом горелок с предварительным смешением является:
1) низкая энергоемкость; 2) возможность точной дозировки отдельных компонентов; 3) удобство в эксплуатации; 4) устойчивость газового факела.
12. Скорость каталитической реакции не зависит от:
1) парциальных давлений реагентов; 2) температуры; 3) порядка реакций по компонентам смеси; 4) молекулярной массы реагентов.
13. Процесс каталитического окисления горючих органических продуктов при низком их содержании в отходящих газах происходит при температуре, ºС:
1) 200…300; 2) 300…400; 3) 400…500; 4) 500…600; 5) 600…700.
14. К числу соединений, даже в малых количествах отравляющих катализатор при каталитическом окислении, относятся
1) бор; 2) медь; 3) сера; 4) калий.
15. В составе выхлопных газов автомобилей наиболее токсичным компонентом является:
1) оксид углерода; 2) формальдегид; 3) бенз(а)пирен; 4) диоксид азота; 5) сажа.
16. Для уменьшения содержания оксидов азота в выхлопных газах автомобилей используют катализаторы:
1) родий; 2) палладий; 3) платину; 4) церий; 5) никель; 6) кобальт.
17. Необходимым условием для использования биохимических методов очистки газов является отношение БПКп:ХПК:
1) 0,1–0,2; 2) 0,3–0,4; 3) > 0,5; 4) <0,4; 5) > 0,3.
Вопросы для повторения
1. Какие методы могут использоваться для очистки газов от газообразных примесей?
2. Что такое абсорбция и каковы физические основы этого процесса?
3. Какие виды абсорбции существуют и чем они отличаются?
4. Какой процесс описывает закон Генри и какова область его применения?
5. Что такое линия равновесия и рабочая линия и как они строятся?
6. Какие механизмы обеспечивают протекание массообменных процессов?
7. Какими уравнениями описываются процессы массообмена при абсорбции?
8. Какие схемы движения жидкости и газа используются в абсорберах и какими уравнениями пользуются при их проектировании?
9. Какие основные типы аппаратов используются для проведения процессов абсорбции?
10. Какие режимы работы наблюдаются в тарельчатых абсорберах и в чем их особенности?
11. Что такое адсорбция и каковы физические причины этого процесса?
12. Какие типы адсорбентов используются в адсорбционных процессах и каковы их основные свойства?
13. Какими уравнениями описываются процессы адсорбции и какова область их применения?
14. Какие типы аппаратов используются для проведения процессов адсорбции и каковы основные особенности их работы?
15. Что такое иониты и как они используются в очистке газов?
16. Как осуществляется регенерация адсорбентов?
17. В каких случаях можно использовать высокотемпературное восстановление при очистке газов?
18. Какие примеси могут быть обезврежены методом высокотемпературного окисления?
19. Когда используют метод прямого сжигания?
20. Какие основные химические реакции протекают при горении?
21. Какие типы оборудования используются для термического обезвреживания газовых выбросов?
22. В чем состоит суть методов каталитической очистки газов?
23. Какими свойствами должны обладать катализаторы?
24. Какие типы катализаторов используются при очистке газов?
25. Какие основные стадии можно выделить в процессе гетерогенного каталитического превращения?
26. От каких факторов зависит скорость каталитической реакции?
27. Какие факторы ухудшают работу катализаторов?
28. Какие методы используются при обезвреживании веществ, обладающих неприятным запахом?
29. Какие загрязняющие вещества поступают в атмосферу при работе двигателей внутреннего сгорания (ДВС)?
30. Как зависит состав выбросов ДВС от режима работы?
31. Какими методами можно сократить выброс загрязняющих веществ от ЛВС в атмосферу?
32. Какие реакции протекают в каталитических нейтрализаторах?
33. В чем сущность метода биохимической очистки газов и когда его можно использовать?
Дата добавления: 2015-05-21; просмотров: 1694;
