Абсорбционные методы очистки газов
Абсорбцией называют процесс избирательного поглощения газообразного компонента (сорбтива) из газообразной смеси жидким поглотителем (абсорбентом).
Если поместить жидкость, в которой уже растворен какой-либо газ, в закрытый сосуд, где над жидкостью имеется газовое пространство, то есть пространство, не занятое жидкостью, то по истечении некоторого времени в это газовое пространство из жидкости выделится часть растворенного в ней газа. Если в жидкости отсутствует какой-либо компонент, содержащийся в газе, то часть его перейдет из газовой фазы в жидкость (растворится в ней).
Данный процесс можно объяснить молекулярно-кинетическими явлениями. При столкновении газовых молекул с жидкостью они растворяются (поглощаются) под действием сил межмолекулярного взаимодействия, но, находясь в жидкости, могут покинуть ее в результате наличия запаса энергии и перейти в газ. При равновесии число молекул, поглощенных жидкостью за одно и то же время, равно числу молекул этого компонента, перешедших из жидкости в газ. При отсутствии равновесия будет преобладать тот или иной процесс до наступления равновесия.
Количество газов, которое может раствориться в жидкости, зависит от свойств газов и жидкостей, а также от условий растворения: температуры жидкости и парциального давления газа над жидкостью. Чем больше парциальное давление газа, тем большее его количество может растворяться в жидкости. Эту зависимость называют законом Генри и выражают ее формулой
pi* = Hixi или yi*=(Нi /P) xi, (90)
где рi* – парциальное давление i-того компонента в газовой смеси при равновесии; yi – молярная (объемная) доля этого компонента в газовой фазе при равновесии; Нi– константа Генри i-того компонента, имеющая размерность давления, Па; xi – молярная доля i-того компонента в жидкости; P – общее давление, Па. Константа Генри увеличивается с ростом температуры. Значения констант Генри для некоторых газов приведены в прил.10.
Графически закон Генри изображается в виде прямой, проходящей через начало координат, тангенс угла наклона ее к оси x равен константе Генри. Эта линия называется линией равновесия.
Закон Генри справедлив для разбавленных растворов. Он нарушается в случае концентрированных растворов, и когда между растворяемым компонентом и жидкостью проходят какие-либо химические или физико-химические взаимодействия (диссоциация, ассоциация и т. д.). Однако даже в этих случаях над любой жидкостью существует равновесное парциальное давление газа, тем большее, чем концентрированнее раствор.
В случае, когда процесс абсорбции идет за счет физического поглощения абсорбентом того или иного газообразного компонента, он называется физической абсорбцией. При наличии химической реакции между поглощаемым компонентом и абсорбентом с образованием нового химического соединения процесс называется хемосорбцией. Возможно сочетание обоих процессов.
Физическая абсорбция является обратимым процессом. Это значит, что при определенных условиях поглощенное вещество можно выделить из жидкой фазы в газовую в концентрированном виде.
Растворимость газов в жидкостях различна. Например, при нормальных условиях (р = 101,3 кПа, Т = 0°С) для хорошо растворимых в воде газов (аммиака, хлористого и фтористого водорода) она измеряется сотнями граммов на 1 кг воды, а для плохо растворимых газов (кислорода, азота, оксида углерода) – десятыми и сотыми долями грамма на 1 кг воды. Хлор и диоксид серы имеют среднюю растворимость. С повышением температуры растворимость газа понижается.
Переход газообразной примеси А в раствор будет происходить до тех пор, пока концентрация ее в растворе не станет равной равновесной концентрации, соответствующей температуре и давлению, при которых находится газ. Чем больше концентрация поглощаемого вещества в растворе отличается от равновесной, тем быстрее будет идти переход примеси из газовой фазы в раствор. Однако в любом случае для достижения равновесной концентрации потребуется некоторое время, а концентрация вещества в растворе в каждый момент времени, пока равновесие не установилось, называется рабочей концентрацией. Зависимость между текущими концентрациями поглощаемого вещества А в газовой и жидкой фазах называется рабочей линией процесса. Она может представлять собой либо прямую, не проходящую через начало координат, либо кри 
 вую (рис.65). Когда газ вступает в химическую реакцию с растворителем или веществами, находящимися в растворе, закон Генри следует применять не к общей концентрации растворенного газа, а к концентрации газа, не вступившего в реакцию. Если скорость химической реакции велика, и поглощаемый компонент быстро переходит в другие химические соединения, концентрация его в растворе близка к нулю.
вую (рис.65). Когда газ вступает в химическую реакцию с растворителем или веществами, находящимися в растворе, закон Генри следует применять не к общей концентрации растворенного газа, а к концентрации газа, не вступившего в реакцию. Если скорость химической реакции велика, и поглощаемый компонент быстро переходит в другие химические соединения, концентрация его в растворе близка к нулю.
В концентрированных растворах растворимость меньше той, которая должна быть по закону Генри. При химическом взаимодействии поглощаемого газового компонента с поглощающей жидкостью равновесное парциальное давление этого компонента над жидкостью обычно очень незначительно.
Поглотительную жидкость или раствор выбирают в основном исходя из химических свойств поглотителя и поглощаемого компонента.
Если газообразную химическую примесь из газа нужно только удалить, то стремятся подобрать поглотитель, который химически реагирует с поглощаемым компонентом. Если же требуется не только очистить газ, но и использовать уловленную примесь, то соответственно подбирают и поглотитель.
Материальный баланс абсорбции. При рассмотрении процесса абсорбции необходимо располагать материальным балансом, на основе которого можно определить расход поглотителя и рассчитать связанные с этим параметры аппаратуры (мощность насосов, размер баков и т. п.).
Обозначим Q – количество газа; L – количество поглотительной жидкости; х1 и х2 – соответственно начальная и конечная концентрации поглощаемого газообразного компонента в поглотительной жидкости;
у1 и y2 – соответственно начальная и конечная концентрации поглощаемого газообразного компонента в очищаемом газе.
Общее количество поглощаемого компонента, которое удалено из газа, G = Q(y1 – у2). Это же количество перешло в жидкость, вследствие чего концентрация в жидкости возросла, т. е
Q(y1– y2) = L (x2 – x1) (91)
Конечная концентрация поглощаемого компонента в газе y2 связана с концентрацией его в жидкости x2 в соответствии с законом Генри.
 Основы расчета процесса абсорбции. Скорость растворения газа в жидкости зависит от свойств жидкости и газа, способа их соприкосновения, величины поверхности соприкосновения и степени насыщения жидкости поглощаемым газом, т. е. приближения раствора к состоянию равновесия с газом по растворимости поглощаемого компонента. Чем менее насыщен раствор, тем больше он поглощает газа. Движущая сила абсорбции равна средней разности концентраций поглощаемого газа в газовой смеси и равновесной концентрации этого компонента в газовой фазе соответственно над поглощающим раствором. Движущую силу абсорбции можно также выразить как разность парциальных давлений поглощаемого компонента в газовой фазе рг и равновесного давления этого компонента над поглотительной жидкостью рт.
Основы расчета процесса абсорбции. Скорость растворения газа в жидкости зависит от свойств жидкости и газа, способа их соприкосновения, величины поверхности соприкосновения и степени насыщения жидкости поглощаемым газом, т. е. приближения раствора к состоянию равновесия с газом по растворимости поглощаемого компонента. Чем менее насыщен раствор, тем больше он поглощает газа. Движущая сила абсорбции равна средней разности концентраций поглощаемого газа в газовой смеси и равновесной концентрации этого компонента в газовой фазе соответственно над поглощающим раствором. Движущую силу абсорбции можно также выразить как разность парциальных давлений поглощаемого компонента в газовой фазе рг и равновесного давления этого компонента над поглотительной жидкостью рт.
Процесс переноса вещества из одной фазы в другую можно представить следующим образом (рис.66). Пусть концентрация распределяемого вещества в фазе G выше равновесной и вещество переходит из фазы G в фазу L.Распределяемое вещество в фазе G переносится к поверхности раздела фаз, а в фазе L переносится от этой поверхности. Перенос вещества в обеих фазах осуществляется путем молекулярной диффузии (т. е диффузии молекул через слойносителя) и путем конвективной диффузии (т. е. движущимися частицами носителя и распределяемого вещества).
В каждой фазе различают две области: ядро (основная масса) и пограничный слой, образующийся у поверхности раздела фаз. Перенос распределяемого вещества в ядре фазы, где обычно происходит интенсивное перемешивание, осуществляется преимущественно путем конвективной диффузии. Вследствие интенсивного перемешивания в ядре концентрация распределяемого вещества в каждом сечении системы почти постоянна. 

 Пограничный слой является областью резкого изменения концентрации распределяемого вещества. Происходящий при абсорбции перенос вещества из одной фазы в другую осуществляется путем как молекулярной, так и турбулентной диффузии. По мере приближения к поверхности раздела фаз происходит затухание конвективных потоков, и возрастает роль молекулярной диффузии. По обе стороны границы между фазами в непосредственной близости от нее расположены газовый и жидкостный ламинарные слои. Растворимый газовый компонент подводится к газовому ламинарному слою за счет турбулентной диффузии, переносится через оба ламинарных слоя за счет молекулярной диффузии и отводится от жидкостного ламинарного слоя снова за счет турбулентной диффузии. Так как скорость турбулентной диффузии во много раз больше скорости молекулярной диффузии, то можно считать, что общее сопротивление процесса переноса равно сумме сопротивлений газового и жидкостного ламинарных слоев.
Пограничный слой является областью резкого изменения концентрации распределяемого вещества. Происходящий при абсорбции перенос вещества из одной фазы в другую осуществляется путем как молекулярной, так и турбулентной диффузии. По мере приближения к поверхности раздела фаз происходит затухание конвективных потоков, и возрастает роль молекулярной диффузии. По обе стороны границы между фазами в непосредственной близости от нее расположены газовый и жидкостный ламинарные слои. Растворимый газовый компонент подводится к газовому ламинарному слою за счет турбулентной диффузии, переносится через оба ламинарных слоя за счет молекулярной диффузии и отводится от жидкостного ламинарного слоя снова за счет турбулентной диффузии. Так как скорость турбулентной диффузии во много раз больше скорости молекулярной диффузии, то можно считать, что общее сопротивление процесса переноса равно сумме сопротивлений газового и жидкостного ламинарных слоев.
Концентрация распределяемого вещества в фазе G уменьшается от величины y в ядре потока до величины yр на границе раздела фаз. В фазе L концентрация распределяемого вещества уменьшается от величины xр на границе раздела фаз до величины x в ядре потока. При установившемся процессе на границе раздела фаз наблюдается равновесие, т. е. концентрации yр и xр являются равновесными, т.е. равными y* и x*.
В процессах физической адсорбции перенос вещества в пределах фазы определяется уравнениями массоотдачи:
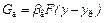 ,
, 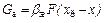 . (92)
. (92)
Перенос вещества из одной фазы в другую определяется уравнениями массопередачи:
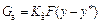 ,
, 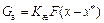 . (93)
. (93)
Связь коэффициента массопередачи с коэффициентом массоотдачи следующая:
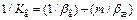 ,
, 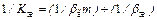 , (94)
, (94)
где Ga – количество вещества переносимого в единицу времени при физической абсорбции, кмоль/ч; 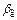 и
и 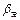 – коэффициенты массоотдачи в газовой и жидкой фазах соответственно, м/ч; F – поверхность контакта фаз, м2; y и x –концентрации передаваемого компонента в газовой и жидкой фазах, кмоль/м3 ур, хр – концентрации передаваемого компонента на границе раздела фаз в газе и жидкости, кмоль/м3; Кг, Кж – коэффициенты массопередачи, отнесенные к концентрации в газовой и жидкой фазах, м/ч; у* – концентрация компонента в газе, равновесная с концентрацией жидкости, кмоль/м3; х – концентрация компонента в жидкости, равновесная с концентрацией газа, кмоль/м3; т – константа фазового равновесия (ур = mхр).
– коэффициенты массоотдачи в газовой и жидкой фазах соответственно, м/ч; F – поверхность контакта фаз, м2; y и x –концентрации передаваемого компонента в газовой и жидкой фазах, кмоль/м3 ур, хр – концентрации передаваемого компонента на границе раздела фаз в газе и жидкости, кмоль/м3; Кг, Кж – коэффициенты массопередачи, отнесенные к концентрации в газовой и жидкой фазах, м/ч; у* – концентрация компонента в газе, равновесная с концентрацией жидкости, кмоль/м3; х – концентрация компонента в жидкости, равновесная с концентрацией газа, кмоль/м3; т – константа фазового равновесия (ур = mхр).
В системах с высокой растворимостью m приближается к 0, поэтому Kг ≈ 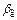 . При малой растворимости газа в жидкости m имеет большое значение, поэтому Кж ≈
. При малой растворимости газа в жидкости m имеет большое значение, поэтому Кж ≈ 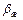 . В этом случае все сопротивление массопередаче сосредоточено в жидкой фазе.
. В этом случае все сопротивление массопередаче сосредоточено в жидкой фазе.
В случае, если абсорбция химическая, уравнения массопередачи аналогичны уравнениям (93), но скорость абсорбции увеличивается вследствие возрастания градиента концентраций у поверхности раздела фаз. Для учета ускорения абсорбции в уравнения массоотдачи вводятся коэффициенты ускорения. Коэффициенты ускорения зависят от скорости химической реакции и степени турбулизации жидкости.
Общая масса вещества, которая поглощается из газовой фазы за время t, равна 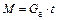 .
.
При проектировании адсорберов обычно рассчитывают поверхность соприкосновения газа и жидкости, которую нужно создать в аппарате для достаточно полного поглощения примеси, и по этой величине определяют размеры аппарата:
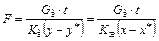 . (95)
. (95)
Количество поглощаемого вещества Gа рассчитывают по материальному балансу, а время t обычно принимают равным 1 ч.
Процессы абсорбции проводят в аппаратах, называемых абсорберами. Абсорберами могут служить скрубберы, которые аналогичны используемым для мокрой очистки газов от пыли. Создание поверхности соприкосновения газа с жидкостью было описано выше, при рассмотрении скрубберов. Подобные же способы применяют и при химической очистке газов. Поверхностью соприкосновения газа с жидкостью F является мокрая поверхность насадки, поверхность капель или пузырьков при барботаже.
При проектировании абсорберов используются различные схемы движения газа и жидкости:
1) газ и жидкость движутся в одну сторону; такое движение называют параллельным током или прямотоком;
2) газ и жидкость движутся в противоположных направлениях; такое движение называют противотоком;
3) газ движется вдоль неподвижной жидкости; в этом случае концентрация жидкости везде одинакова, но изменяется по мере поглощения данного компонента из газа.
Два первых вида соприкосновения газа с жидкостью относятся к процессам непрерывным, а третий – к периодическим, когда газ поступает непрерывно, а поглотительную жидкость периодически меняют в промывном аппарате.
Три основных вида движения жидкости и газа в абсорбционных аппаратах не исчерпывают все встречающиеся в практике варианты осуществления процесса абсорбции, в большинстве случаев другие варианты можно с той или иной степенью приближения отнести к одному из этих видов.
При противотоке лучше используется поглотительная жидкость – она в большей степени насыщается и более полно очищает газ. Это объясняется тем, что очищенный газ перед выходом из скруббера соприкасается со свежей жидкостью, движущая сила процесса абсорбции больше, так как концентрация поглощаемого вещества в поступающем в аппарат поглотителе, как правило, равна нулю.
При прямотоке жидкость перед выходом из скруббера соприкасается уже с очищенным газом. Следовательно, она может содержать поглощаемый компонент только в том количестве, которое отвечает равновесному по отношению к очищенному, т. е. слабо концентрированному газу.
При расчетах величины требуемой поверхности соприкосновения, а следовательно, и размера самого поглотительного аппарата приходится определять среднее значение движущей силы абсорбции, так как движущая сила не одинакова в начале и конце процесса.
Из уравнения материального баланса (91) можно также определить количество жидкости, необходимое для поглощения требуемого количества примеси. При расчетах расхода жидкости следует помнить, что конечная концентрация поглощаемого компонента в газе связана с концентрацией его в жидкости согласно закону Генри. Поэтому перед тем, как рассчитывать величину L, нужно правильно рассчитать значения у2и х2.
При очистке газов от газообразных химических примесей промывкой жидкостями следует, с одной стороны, создать хороший контакт между газом и жидкостью, а с другой стороны, подобрать такую жидкость, которая хорошо поглощала бы нужный компонент, но не реагировала с другими компонентами, содержащимися в газе.
Физическую абсорбцию водой в чистом виде можно применить только для хорошо растворимых газов (аммиака, хлористого и фтористого водорода).
Абсорбция диоксида серы будет нецелесообразна из-за большого расхода воды. Удаление из газов оксида углерода путем промывки водой практически невозможно, так как в воде этот газ растворим очень плохо.
Плохо растворимые компоненты в некоторых случаях можно удалять из газов, промывая их жидкостями, химически реагирующими с поглощаемым компонентом, т. е. применяя хемосорбцию.
Десорбцию осуществляют отгонкой в токе инертного газа, подводом тепла к абсорбенту, снижением давления газа над абсорбентом.
 С ростом давления и снижением температуры скорость абсорбции увеличивается. Абсорбенты, работающие при отрицательных (по Цельсию) температурах, принято называть хладоносителями, а процесс абсорбции, протекающий в таких условиях – контактной конденсацией.
С ростом давления и снижением температуры скорость абсорбции увеличивается. Абсорбенты, работающие при отрицательных (по Цельсию) температурах, принято называть хладоносителями, а процесс абсорбции, протекающий в таких условиях – контактной конденсацией.
При растворении газа в жидкости выделяется большое количество теплоты. При отсутствии отвода теплоты температура повышается, что ведет к уменьшению движущей силы процесса и ухудшению условий адсорбции. Поэтому обычно процесс абсорбции проводят с интенсивным отводом теплоты.
По способу диспергирования абсорбента можно выделить распылительные (брызгальные), пленочные, барботажные и пенные устройства. По способу организации массообмена абсорбционные аппараты принято делить на устройства с непрерывным и ступенчатым контактом фаз. К аппаратам с непрерывным контактом можно отнести насадочные колонны, распылительные аппараты (полые скрубберы, скрубберы Вентури, ротоклоны и др.), однопольные мокрые электрофильтры, однополочные барботажные и пенные устройства. К устройствам со ступенчатым контактом относятся тарельчатые колонны, многопольные мокрые электрофильтры, многополочные барботажные и пенные аппараты.
Часть подобных устройств, применяемых для мокрой пылеочистки, была рассмотрена в предыдущих разделах. В принципе их можно было бы использовать и для совместного улавливания дисперсных и газовых загрязнителей, однако осуществить это на практике удается редко. Очистные устройства создавались и совершенствовались либо для поглощения газообразных примесей, либо для пылезолоулавливания. Поэтому современные абсорберы для улавливания газообразных примесей не приспособлены для обработки потоков с дисперсными загрязнителями. Высокоэффективные пылезолоуловители, как правило, непригодны для сколько-нибудь существенного извлечения газообразных загрязняющих веществ и могут быть использованы только как предварительная ступень очистки с целью освобождения газового потока от дисперсных примесей перед абсорбционной обработкой.
Для абсорбции газовых загрязнителей наиболее распространены насадочные и тарельчатые колонны.
 В насадочных колоннах (рис.67) обеспечивается лучший контакт обрабатываемых газов с абсорбентом, чем в полых распылителях, благодаря чему интенсифицируется процесс массопереноса, и уменьшаются габариты очистных устройств.
В насадочных колоннах (рис.67) обеспечивается лучший контакт обрабатываемых газов с абсорбентом, чем в полых распылителях, благодаря чему интенсифицируется процесс массопереноса, и уменьшаются габариты очистных устройств.
Эффективность массопередачи в насадочных колоннах зависит от равномерности распределения потоков контактирующих фаз, соотношения их скоростей и условий орошения элементов насадки.
Начальная равномерность распределения абсорбента достигается посредством ее диспергированной подачи на поверхность насадки через распылительные форсунки или распределительные тарелки с большим числом отверстий. При дальнейшем передвижении жидкости ее контакт с газовой фазой ухудшается из-за оттока к стенкам колонны. Поэтому высоту насадки делят на несколько слоев (ярусов), устанавливая между ними перераспределительные устройства. Для этой цели могут использоваться ситчатые или перфорированные диски (тарелки). Одновременно они выполняют функцию несущей конструкции для каждого яруса.
Поскольку часть отверстий тарелки может быть завалена элементами насадочного слоя, то она должна превосходить насадку по величине живого сечения. Недостаточное орошение элементов насадки ведет к неполному использованию поверхности ее контакта. Значительный избыток жидкости может вызвать частичное затопление насадки, что также ведет к ухудшению контакта фаз на поверхности насадочных элементов.
Точный расчет пределов плотности орошения невозможен. Ориентировочно минимальную плотность орошения ρн, м3/ч на 1 м2 поверхности насадки (сечения скруббера), можно принять как 0,12a , где a – удельная поверхность насадки, м2/м3, а максимальную плотность орошения – в 4–6 раз выше минимальной. Существуют и другие, более сложные эмпирические соотношения для определения плотности орошения.
 Для определения коэффициентов массопередачи необходимо иметь данные о равновесных концентрациях примеси и поглотителя в рабочих условиях. Для расчета массообменных процессов обычно используют критериальные уравнения, полученные с использованием теории подобия. Формулы для расчета коэффициента абсорбции-массопередачи приведены в специальной литературе [20,21]. Ориентировочно для определения коэффициента абсорбции-массопередачи хорошо растворимых газов можно использовать график (рис.68).
Для определения коэффициентов массопередачи необходимо иметь данные о равновесных концентрациях примеси и поглотителя в рабочих условиях. Для расчета массообменных процессов обычно используют критериальные уравнения, полученные с использованием теории подобия. Формулы для расчета коэффициента абсорбции-массопередачи приведены в специальной литературе [20,21]. Ориентировочно для определения коэффициента абсорбции-массопередачи хорошо растворимых газов можно использовать график (рис.68).
Движущую силу абсорбции (массопередачи) можно выражать не только через разность концентраций, но и через разность парциальных давлений. Общий вид выражения (93) от этого не изменится, но значение коэффициента массопередачи будет другим. Необходимо также учитывать, что при подсчете движущей силы абсорбции (массопередачи) следует выбирать разность между величиной, характеризующей содержание поглощаемого компонента в очищенном газе, и величиной, характеризующей равновесное значение этого компонента по отношению к жидкости. При подсчете разности необходимо обе величины выражать в одних и тех же единицах измерений. В зависимости от способа выражения движущей силы процесса абсорбции изменяется размерность и численные значения коэффициента массопередачи.
Если движущая сила изменяется в процессе абсорбции, то в расчетах используют среднее значение движущей силы, вычисляемое как среднеарифметическое Δpвх и Δpвых процесса, а если отношение Δpвх/Δpвых>2, то среднее значение движущей сила процесса находится как среднее логарифмическое:
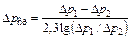 . (96)
. (96)
Тарельчатые абсорберы представляют собой колонны с установленными внутри них тарелками различных типов: ситчатых, колпачковых, провальных и др. Тарельчатые колонны в зависимости от скорости газа могут работать при различных режимах.
Режим неравномерной работы наблюдается при малых скоростях газа в свободном сечении колонны w < 0,5 м/с. При рассматриваемом режиме образующаяся на тарелке двухфазная система состоит из трех зон по высоте (считая снизу вверх): зоны собственно барботажа (газ распределяется в виде пузырьков или газовых мешков – факелов), зоны неподвижной пены и зоны брызг. В колпачковых тарелках прорези колпачков при такой скорости газа не полностью открыты, имеет место пузырьковый режим барботажа. В ситчатых тарелках жидкость проваливается через отверстия и не успевает накапливаться на тарелках.
Режим равномерной работы наступает при дальнейшем увеличении скорости газа (до 1 м/с). При этом увеличивается высота зоны пены и уменьшается высота зоны собственно барботажа. В известных условиях зона собственно барботажа исчезает полностью и возникает так называемый пенный режим. Равномерный режим работы колпачковых тарелок характеризуется полным раскрытием прорезей всех колпачков и струйным движением газа (пара) через жидкость. В ситчатых тарелках истечение газа (пара) в жидкость происходит через все отверстия.
Режим газовых струй и брызг наблюдается при повышении скорости газа (пара) более 1 м/с. В этом случае газ движется через жидкость в виде струй (факелов), которые выходят на поверхность пены, причем пена разрушается. В результате над пеной появляется большое количество брызг. При дальнейшем увеличении скорости газа (пара) наблюдается инжекционный режим: жидкость захватывается выходящим из отверстий газом и в значительной степени уносится с ним в виде брызг.
В зависимости от конструктивных особенностей тарелок определяется оптимальная скорость газа, плотность орошения и гидравлическое сопротивление колонны. Расчет гидравлического сопротивления ведется аналогично расчету подобных мокрых пылеуловителей. Степень очистки определяется по формуле (29), где количество поглощенного вещества определяется из уравнений материального баланса.
Дата добавления: 2015-05-21; просмотров: 4906;
