Соотношения Максвелла.
Рассмотрим теперь вторые смешанные производные характеристических функций. Принимая во внимание уравнения (III, 23а) - (III, 26а), можем записать:
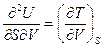 (III, 27)и
(III, 27)и
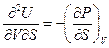 (III, 28)
(III, 28)
Значение смешанных производных непрерывной функции не зависит от порядка дифференцирования, поэтому, если в уравнениях (III, 27)и(III, 28)равны левые части уравнений, то равны и их правые части:
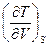 =
= 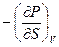
Справедливость полученного уравнения не изменится, если его «перевернуть», т.е. представить в следующем виде:
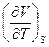 =
= 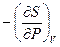 (III, 29)
(III, 29)
Полученное уравнение (III, 29) принадлежит к числу так называемых соотношений Максвелла.Совершенно аналогично можно получить три других соотношения:
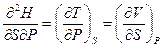 или
или
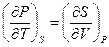 (III, 30)
(III, 30)
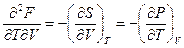 или
или
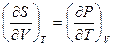 (III, 31)
(III, 31)
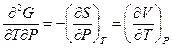 или
или
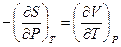 (III, 32)
(III, 32)
Эти соотношения позволяют при необходимости переходить от одних частных производных к другим, заменяя частные производные, которые не могут быть непосредственно определены на опыте (производные энтропии по параметрам Р и V) на величины, которые заведомо легче связать с экспериментом (производные давления или объема по температуре и другие). Поэтому роль соотношений Максвелла, особенно
(III, 31)и(III, 32),в термодинамике чрезвычайно велика.
Приведем только один пример. Из объединенного первого и второго законов термодинамики следует:
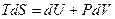
Если разделить обе части последнего уравнения на 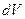 , считая температуру Т постоянной, получим:
, считая температуру Т постоянной, получим:
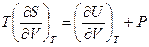
Заменяя теперь 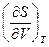 из третьего соотношения Максвелла (смотри (III, 31))на
из третьего соотношения Максвелла (смотри (III, 31))на 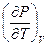 , после простых преобразований получим:
, после простых преобразований получим:
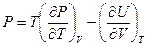 (III, 33)
(III, 33)
Для одного моля идеального газа 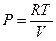 . Подставляя это выражение в левую и правую части уравнения (III, 33)и считая объем постоянным, после дифференцирования будем иметь:
. Подставляя это выражение в левую и правую части уравнения (III, 33)и считая объем постоянным, после дифференцирования будем иметь:
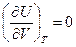
Полученный результат означает независимость внутренней энергии идеального газа от объема (и давления) при постоянной температуре. Это положение, принятое нами на основании опыта Гей-Люссака – Джоуля (смотри стр.15), после приведенного вывода непосредственно вытекает из самого уравнения состояния идеального газа и законов термодинамики.
Дата добавления: 2015-05-21; просмотров: 832;
