Глава XII. Цепные реакции.
Цепными называются реакции. которые протекают с участием свободных атомов, радикалов или иных активных частиц, исчезающих и вновь возникающих в отдельных элементарных актах, и состоящие из большого числа повторяющихся стадий.
Изучение этих реакций имеет большое значение для исследования процессов горения, крекинга нефти, производства пластмасс, ядерных процессов. Теория цепных реакций разрабатывалась В. Нернстом, М. Боденштейном, С. Гиншелвудом, Н.Н. Семеновым и его школой.
Для цепных реакций наблюдается ряд закономерностей, не позволяющий объяснить механизм их протекания простой перегруппировкой атомов. К ним относятся зависимость скорости цепной реакции от размера, формы и материала сосуда, в котором находится реакционная смесь; зависимость скорости реакции от ничтожных добавок посторонних веществ; резкое увеличение скорости процесса для определенного интервала давлений и др.
Существование свободных радикалов обнаруживают, используя спектроскопические методы, метод электронного парамагнитного резонанса, химический метод и т.д.
Типичным примером цепной реакции служит реакция взаимодействия хлора с водородом на свету. Если хотя бы очень кратковременно подвергнуть смесь (Н2 + Сl2) интенсивному освещению, то происходит быстрая реакция образования HCl. Эта реакция начинается через некоторое время после начала освещения и продолжается после его прекращения.
Нернст предложил следующий механизм этой реакции. Сначала происходит взаимодействие фотонов с молекулами хлора, приводящее к образованию свободных радикалов - атомов хлора:
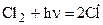 .
.
Реакции, в результате которых возникают первичные активные частицы, называются зарождением цепи.
Затем следует цепь элементарных реакций превращения исходных продуктов в конечные, протекающих с участием свободных радикалов (развитие цепи):
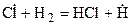 .
.
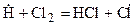 .
.
Эта группа реакций повторяется многократно.
В результате столкновения активных частиц происходит обрыв цепи:
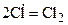 или
или 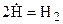 .
.
Рассмотренная выше реакция синтеза HCl является примером простой цепи. В этом случае число первоначально возникших активных частиц не изменяется: взамен какой-либо одной активной частицы, вступившей в отдельную стадию, образуется новая активная частица, являющаяся продуктом этой стадии.
Если N0 - число активных частиц, возникающих в реакционном объеме в одну секунду, то скорость процесса с простой цепью определится из выражения:
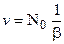 , (12.1)
, (12.1)
где 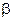 - вероятность гибели активной частицы;
- вероятность гибели активной частицы;
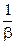 - длина цепи.
- длина цепи.
Из (12.1) очевидно, что чем больше вероятность гибели активной частицы, тем меньше скорость цепной химической реакции.
Когда расход одной или нескольких активных частиц приводит к образованию большого числа таких же частиц, цепная реакция называется разветвленной. Примером разветвленной цепной реакции является реакция горения водорода:
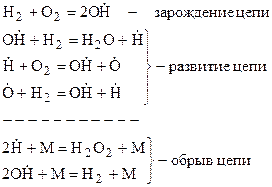
Для зарождения цепи при высокой температуре достаточно прямого взаимодействия водорода с кислородом. Особенностью развития цепи является то, что поглощение одного атома 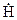 , необходимого для осуществления этой группы реакций, приводит затем к образованию трех новых радикалов (
, необходимого для осуществления этой группы реакций, приводит затем к образованию трех новых радикалов ( 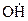 ,
, 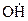 и
и 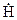 ). Такое размножение активных частиц - причина цепных взрывов.
). Такое размножение активных частиц - причина цепных взрывов.
Если 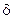 - вероятность разветвления, то скорость цепной химической реакции с разветвленной цепью рассчитывается:
- вероятность разветвления, то скорость цепной химической реакции с разветвленной цепью рассчитывается:
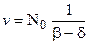 , (12.2)
, (12.2)
где 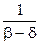 - длина цепи.
- длина цепи.

|
Очевидно, что если 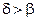 , то имеется неограниченное увеличение скорости цепной химической реакции. Для реакций с неразветвленной цепью
, то имеется неограниченное увеличение скорости цепной химической реакции. Для реакций с неразветвленной цепью 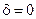 .
.
| Рис. 12.1. Зависимость скорости цепной реакции от давления. |
Весьма своеобразной является зависимость скорости разветвления цепных реакций от давления. Первоначально не идущая реакция с повышением давления может принять взрывной характер, но при еще больших давлениях опять прекратиться. Это объясняется тем, что при малых давлениях столкновения между частицами газа редки, а активные частицы, достигая стенок сосуда, поглощаются ими. С другой стороны, при слишком высоких давлениях часто происходят тройные столкновения, также приводящие к прекращению реакции. И лишь только в некотором интервале средних давлений обрывы цепей как на стенках сосуда, так и в объеме смеси малы и разветвленная цепь может вовлечь большое число молекул реагентов и даже протекать со взрывом (рис. 12.1).
Давления, при которых происходит резкое увеличение скорости цепных реакций, называются верхним и нижним пределами самовоспламенения или взрываемости.
Так как при малых давлениях решающее значение имеют обрывы на стенках, нижний предел воспламенения (Р1) заметно зависит от материала и размеров реакционного сосуда, но мало изменяется с температурой. Можно считать, что скорость цепной реакции пропорциональна квадрату диаметра со7суда.
Верхний предел воспламенения (Р2) мало зависит от формы сосуда, но сильно зависит от температуры и наличия примесей.
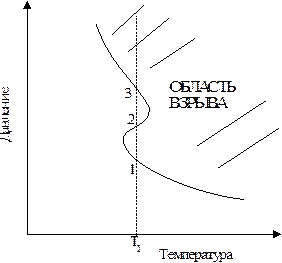
|
Качественная зависимость пределов взрываемости от температуры представлена на рис.12.2.
Точка 1 отвечает нижнему, а точка 2 - верхнему пределу взрываемости при температуре Т1.
| Рис.12.2. Влияние температуры на пределы взрываемости |
На рис. 12.2 показан, кроме того, и третий предел взрываемости (точка 3), который наблюдается для некоторых реакций. Третий предел чаще всего обусловлен развитием так называемого теплового взрыва. Он возможен для экзотермических реакций и связан с разогревом смеси вследствии недостаточного теплоотвода. Как известно, с повышением температуры скорость реакций возрастает, а поэтому увеличивается и количество выделяющейся энергии, что приводит к еще большему повышению температуры, а затем и к дальнейшему увеличению скорости реакции.
Дата добавления: 2015-05-21; просмотров: 2524;
