Энергия Гиббса. Энергия Гельмгольца.
Энтропия - основная функция, позволяющая судить о направлении самопроизвольных процессов в изолированных системах. Чтобы использовать ее в практических целях нужно исследовать как самое систему, так и ее окружение. Хотя рассчитать изменение энтропии окружения или окружающей среды довольно просто 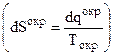 , можно предложить метод, автоматически учитывающий наличие окружающей среды.
, можно предложить метод, автоматически учитывающий наличие окружающей среды.
Из первого закона термодинамики следует:
dq = dU +dA.
Из второго закона:
dq 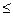 TdS,
TdS,
поэтому
TdS 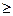 dU + dA. (4.51)
dU + dA. (4.51)
Неревенство (4.51) представляет собой обобщенную форму записи первого и второго начал термодинамики.
Из (4.51) следует, что:
dA 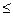 TdS - dU. (4.52)
TdS - dU. (4.52)
При постоянных Т и V (4.52) интегрируется непосредственно:
AV 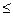 T(S2 - S1) - (U2 - U1)
T(S2 - S1) - (U2 - U1)
или
AV 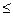 TS2 - TS1 - U2 + U1,
TS2 - TS1 - U2 + U1,
откуда
AV 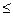 -[( U2 - TS2) - (U1 - TS1)], (4.53)
-[( U2 - TS2) - (U1 - TS1)], (4.53)
где U - TS = F, поэтому:
AV 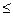 -( F2 - F1) или
-( F2 - F1) или 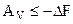 . (4.54)
. (4.54)
F - новая функция состояния, называемая энергией Гельмгольца (свободная энергия при постоянном объеме системы или изохорно-изотермический термодинамический потенциал).
Соотношение (4.54) читается: “... работа неизолированной системы в условиях V, T = const не более убыли энергии Гельмгольца”.
Величина АР = AV - p 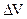 есть величина максимальной полезной работы, где АV - максимальная полная работа.
есть величина максимальной полезной работы, где АV - максимальная полная работа.
По аналогии АР может быть определена в виде разности двух значений некоторой функции G - энергии Гиббса:
AР 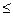 -( G2 - G1) или
-( G2 - G1) или  . (4.55)
. (4.55)
Так же как энтальпия отличается от внутренней энергии на величину pV, так и G отличается от F на величину pV:
G = F + pV = U - TS + pV = H - TS. (4.56)
Итак, окончательно:
F = U - TS и G = H - TS, (4.57)
где F и G - новые функции состояния.
Дата добавления: 2015-05-21; просмотров: 711;
