Зависимость теплового эффекта химической реакции от температуры
(уравнение Кирхгофа).
Большинство экспериментальных определений теплот реакций относится к комнатной температуре, хотя практически важно знать его значение при любой температуре. Первое начало термодинамики позволяет определить зависимость теплового эффекта от температуры и осуществлять соответствующие термохимические расчеты.
Для реакции вида:
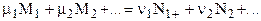 , (3.21)
, (3.21)
где 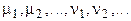 - коэффициенты;
- коэффициенты;
М1, М2, ..., N1, N2, ... – продукты химической реакции, тепловой эффект 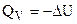 .
.
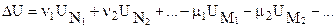 . (3.22)
. (3.22)
Тогда:
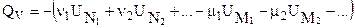 . (3.23)
. (3.23)
После дифференцирования по температуре:
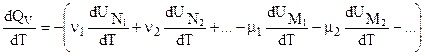 , (3.24)
, (3.24)
где 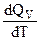 - температурный коэффициент теплового эффекта химической реакции;
- температурный коэффициент теплового эффекта химической реакции;
Учитывая, что 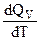 = СV:
= СV:
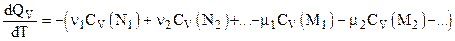 (3.25)
(3.25)
или
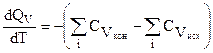 . (3.26)
. (3.26)
Уравнение (3.26) – уравнение Кирхгофа в дифференциальной форме записи, которое читается:
“Температурный коэффициент теплового эффекта химической реакции равен изменению теплоемкости системы за счет этой реакции.”
Если 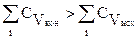 , то
, то 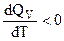 , т. е. с повышением температуры тепловой эффект химической реакции уменьшается.
, т. е. с повышением температуры тепловой эффект химической реакции уменьшается.
Если 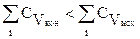 , то
, то 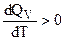 и с повышением температуры тепловой эффект химической реакции возрастает.
и с повышением температуры тепловой эффект химической реакции возрастает.
При 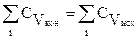 , то
, то 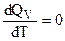 и температура не влияет на величину теплового эффекта химической реакции.
и температура не влияет на величину теплового эффекта химической реакции.
После разделения переменных и интегрирования:
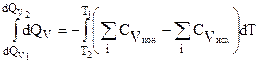 . (3.27)
. (3.27)
где 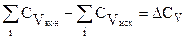 .
.
Тогда
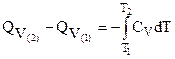 (3.28)
(3.28)
и по аналогии:
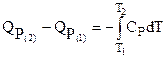 . (3.29)
. (3.29)
Уравнения (3.28) и (3.29) – уравнения Кирхгофа в интегральной форме записи.
В обобщенной форме записи:
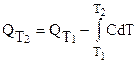 . (3.30)
. (3.30)
Кроме того:
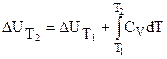 , (3.31)
, (3.31)
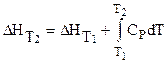 . (3.32)
. (3.32)
Таким образом, для нахождения величины теплового эффекта химической реакции при заданной температуре необходимо знать его величину при любой другой температуре и располагать уравнениями Сi = f (T).
Дата добавления: 2015-05-21; просмотров: 983;
