Зависимости для идеального газа
Под идеальным понимается такой газ, у которого объем, занимаемый молекулами газа, пренебрежительно мал по сравнению с заполняемым им объемом и отсутствуют силы взаимного притяжения. Для идеального газа справедливы законы, определяющие взаимную связь основных термодинамических параметров его состояния по уравнению (2.1).
Зная два параметра состояния, например V и Т, можно найти третий параметр – р.
Закон Бойля–Мариотта для процесса при постоянной температуре (Т = const) записывается в виде выражения
p1V1 = p2V2= const.(2.2)
Закон Гей-Люссака для процесса при постоянном давлении (р = const) выглядит следующим образом:
V = V0 (1 + αpt) и V/T = const, (2.3)
здесь ap = 1/273,16 – средний коэффициент термического расширения при р = const.
Характеристическое уравнение Клапейрона–Менделеева имеет вид
pV = GRT,(2.4)
для 1 кг рυ = RT,
Закон Авогадро гласит, что в равных объемах идеальных газов при одинаковых давлении и температуре содержится одинаковое число молекул:
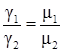 или
или 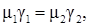 (2.7)
(2.7)
где 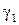 ,
,  – удельный вес газов.
– удельный вес газов.
Уравнение Клапейрона–Клаузиуса характеризует изменения равновесного давления (по кривой фазового равновесия) в зависимости от температуры:
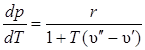 , (2.10)
, (2.10)
где r – удельная теплота фазового перехода;  – удельный объем насыщенной жидкости;
– удельный объем насыщенной жидкости;  – удельный объем сухого насыщенного пара.
– удельный объем сухого насыщенного пара.
Зависимости для газовых смесей соответствуют характеристическому уравнению.
Закон Дальтона для газовой смеси определяет связь между давлением смеси рсм и парциальными давлениями рi отдельных компонентов в смеси газа:
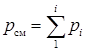 . (2.11)
. (2.11)
Дата добавления: 2015-05-16; просмотров: 1213;
