Неферментативная антиоксидантная система
"Липидные антиоксиданты" - производные фенола, способны инактивировать свободные радикалы в гидрофобном слое мембран и предотвращать развитие ПОЛ. К ним относится α-токоферол (витамин Е), убихинон (коэнзим Q), тироксин и синтетические соединения, например ионол (бутилированный гидрокситолуол).
Витамин Е (α-токоферол) самый распространённый липофильный антиоксидант, он обеспечивает защиту мембран от СРО. Различают 8 типов токоферолов, но α-токоферол наиболее активен. α-Токоферол отдаёт атом водорода радикалу липида ROO∙, восстанавливает его до гидропероксида (ROOH), а сам превращается в малоактивный свободный радикал, что прерывает ПОЛ:
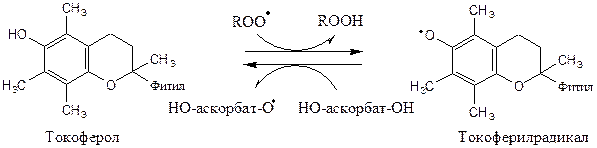
Регенерацию α-токоферола осуществляет витамин С.
Свободный радикал витамина Е стабилен и не поддерживает ПОЛ, он взаимодействует с радикалами липидных перекисей, восстанавливает их, а сам превращается в стабильную окисленную форму — токоферолхинон.
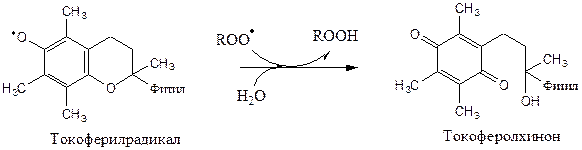
Витамин С ингибирует СРО с помощью двух различных механизмов:
1). восстанавливает в мембранах токоферолхинон до витамина Е:
НО-аскорбат-ОН + α-ТФ-О· → α-ТФ-ОН + НО-аскорбат-О· (семидегидроаскорбиновая к-та)
НО-аскорбат-О· + α-ТФ-О· → α-ТФ-ОН + О=аскорбат=О (дегидроаскорбиновая к-та)
Регенерация аскорбиновой кислоты идет с участием ферментативных систем:
а). В микросомах, с участием комплекса НАДН2-редуктаза-цитохром b5:
2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД+
б). В митохондриях, с участием НАДН2-семидегидроаскорбатредуктазы:
2НО-аскорбат-О· + НАДН2 → 2НО-аскорбат-ОН + НАД+
в). В цитозоле, с участием НАДФН2-дегидроаскорбатредуктазы:
О=аскорбат=О + 2НАДФН2 → НО-аскорбат-ОН + 2НАДФ+
г). В цитозоле, с участием GSH-дегидроаскорбатредуктазы:
О=аскорбат=О + 2GSH → НО-аскорбат-ОН + GS-SG
2). взаимодействует с активными формами кислорода — О∙2, Н2О2, НО∙ и инактивирует их.
β-Каротин, предшественник витамина А, также обладает антиоксидантным действием и ин-гибирует ПОЛ.
Соединения, связывающие железо. Большинство из них, включая такие природные соединения как дипептид карнозин, не просто связывают железо, но, самое главное, не дают ему возможности приникнуть в липидную фазу мембран, поскольку образующиеся комплексы, в силу своей полярности, не проникают в гидрофобную зону.
Для детоксикации двухвалентного железа в организме существует, по-видимому, целая система окисления и связывания ионов железа. В плазме крови эта система представлена ферментом церрулоплазмином (феррооксидазой), который окисляет Fe2+ до Fe3+ кислородом без образования свободных радикалов, и белком трансферрином, который связывает и переносит в кровяном русле ионы трехвалентного железа, которые затем захватывается клетками. В клетках железо может восстанавливаться аскорбиновой кислотой и другими восстановителями, но затем окисляется и депонируется в окисленной форме внутри ферментного белкового комплекса ферритина.
Литература:
- В.В. Кржечковская, А.А. Кубатиев, Ю.И. Наумов. Мембраносвязанный цитохром b5 и метаболизм липидов (реакции не связанные с участием системы цитохрома р -450). Серия. Критические технологии. Мембраны, 2004, № 2 (22).
Дата добавления: 2015-05-08; просмотров: 2448;
