Загальна характеристика класу оксосполук
Динамічна характеристика різання як елемента динамічної системи верстата являє собою залежність сили різання від відносного зміщення заготовки та інструмента, яке обумовлює цю силу.
Використовуючи цю характеристику, можна розрахунком визначити вплив режимів різання, геометрії інструменту і оброблюваного матеріалу на динамічні процеси, що проходять в верстатах і, зокрема, на умови виникнення автоколивань при різанні.
Динамічна характеристика процесу різання може бути побудована тільки для умов, коли процес різання є власно сталим, тобто для умов утворення зливної стружки.
Розглянемо, згідно В.О. Кудінову, лінійні зміщення в напрямку трьох осей координат XYZ при вільному прямокутному різанні (рис. 8.8).
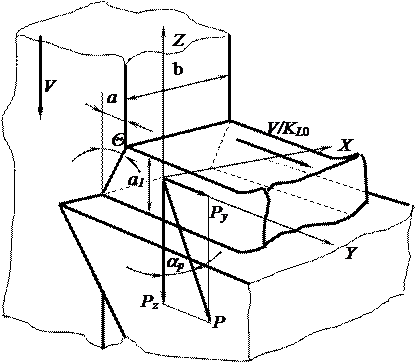 |
Рисунок 8.8 – Схема зони різання при утворенні зливної стружки
Зміщення по нормалі до поверхні різання (в напрямку осі Y) викликає зміну: товщини a шару, що видаляється; швидкості ковзання стружки по передній поверхні різця; переднього кута, а також заднього кута.
Зміщення по дотичній до поверхні різання в напрямку швидкості різання (по осі Z ) викликає зміну швидкості різання.
Зміщення по дотичній до поверхні різання (по осі X) викликає зміну швидкості різання і швидкості переміщення стружки по передній поверхні стружки, але, як показує практика, мало впливає на силу різання і може не враховуватись.
Для названих відносних зміщень динамічна характеристика процесу різання, з урахуванням сил на передній і задній поверхнях леза, має вигляд:
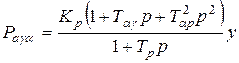 ,
,
де Kp – коефіцієнт різання, Kp = K b;
Tag – величина, що визначається за формулою Tag =Ta – Tg;
Tap – величина, що визначається за формулою Tap = 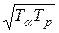 ;
;
b – ширина зрізу;
p – символ диференціювання;
y – переміщення в напрямку осі Y.
В свою чергу:
Tр – постійна часу стружкоутворення
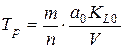 ;
;
Tg – постійна часу переднього кута
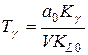 ;
;
Ta – постійна часу заднього кута
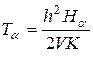 .
.
В наведених формулах постійних часу стружкоутворення, переднього та заднього кутів:
m – безрозмірна координата, що визначає положення сили, яка діє на умовній площині зсуву;
n – безрозмірна координата, що визначає положення сили, яка діє на передній поверхні різця;
a0 – деяке задане значення товщини зрізу, від якого розглядається зміна товщини стружки;
KL0 – деяке задане значення коефіцієнту укорочення стружки;
V – швидкість різання;
Kg – коефіцієнт;
Ha – коефіцієнт пропорціональності;
K – питома сила різання, тобто сила, яка діє на одиниці площі поперечного перерізу шару, що зрізається;
h – висота фаски на задній поверхні різця.
Було встановлено, що для умов, які охоплюють область низькочастотних автоколивань (0 < f <10 Гц), вплив змінювання переднього і заднього кутів незначний. Одначе при обробленні з малим зсаджуванням матеріалів, що мають невелику пластичність, а також в області високих частот вплив змінювання переднього кута стає суттєвим. Вплив заднього кута також збільшується по мірі затуплення інструменту. І те і друге приводить до збільшення постійних часу переднього і заднього кутів.
Використання поняття постійної часу стружкоутворення є дуже суттєвим в динамічній оцінці процесу різання. Воно встановлює прямий зв’язок з величиною укорочення стружки і зворотну залежність від швидкості різання, враховує вплив властивостей оброблюваного матеріалу, режимів оброблення і геометрії інструменту на умови виникнення автоколивань та динамічні процеси різання.
План
1. Загальна характеристика класу оксосполук.
2. Будова, ізомерія, номенклатура альдегідів та кетонів.
3. Способи добування альдегідів та кетонів жирного та ароматичного ряду.
4. Фізичні властивості альдегідів та кетонів.
Ключові слова: оксосполуки, функціональна група, оксогрупа, карбонільна група, альдегід, кетон, етеналь, ацетон, гемінальні дигалогеналкани, реакція Розенмунда, реакція Гатермана-Коха, оксосинтез.
Література: [1] с. 150 - 159; [3] с. 276-283
Загальна характеристика класу оксосполук
Оксосполуки — органічні речовини, які містять в молекулі оксогрупу (карбонільну групу) 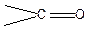 .
.
До оксосполук відносяться альдегіди та кетони. Альдегідами називаються сполуки, в яких карбонільна група сполучена з вуглеводневим залишком і Гідрогеном, кетонами – якщо вона сполучена з двома вуглеводневими залишками:
В залежності від характеру вуглеводневих радикалів, які входять в молекули альдегідів або кетонів, розрізнюють насичені, ненасичені, циклічні, ароматичні й гетероциклічні альдегіди і кетони. Кетони, крім того, бувають змішаного типу: радикали, з якими зв’язана кетогрупа, можуть належати до різних класів вуглеводнів.
1. Будова, ізомерія, номенклатура альдегідів та кетонів
За номенклатурою IUPAC в основі назв альдегідів лежить назва вуглеводню з тим же числом атомів Карбону, включаючи атом Карбону карбонільної групи, до якого додають закінчення  , а кетони — додаючи закінчення
, а кетони — додаючи закінчення 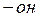 . Нумерація ланцюга альдегідів починається з Карбону карбонільної групи, а кетонів — з кінця ланцюга, ближче до якого розташована карбонільна група. За тривіальною номенклатурою альдегіди називають за відповідними кислотами, на які вони перетворюються окисненням, із додаванням у кінці назви слова „альдегід”. За радикально-функціональною номенклатурою назви кетонів складають (за алфавітом) із назв вуглеводневих залишків (радикалів), які зв’язані з карбонільною групою, з додаванням слова „кетон”.
. Нумерація ланцюга альдегідів починається з Карбону карбонільної групи, а кетонів — з кінця ланцюга, ближче до якого розташована карбонільна група. За тривіальною номенклатурою альдегіди називають за відповідними кислотами, на які вони перетворюються окисненням, із додаванням у кінці назви слова „альдегід”. За радикально-функціональною номенклатурою назви кетонів складають (за алфавітом) із назв вуглеводневих залишків (радикалів), які зв’язані з карбонільною групою, з додаванням слова „кетон”.
Ізомерія альдегідів пов’язана з будовою вуглеводневого залишку, а кетонів — з ізомерією карбонового ланцюга та положенням функціональної групи. Ізомерія характерна для тих кетонів, у молекулах яких є п’ять і більше атомів Карбону.
В таблиці 10.1.1 наведена структура та назви деяких альдегідів і кетонів.
Таблиця 10.1.1 Гомологічний ряд і номенклатура альдегідів і кетонів
| Формула | Номенклатура | |||
| Тривіальна | Систематична IUPAC | |||
| Альдегіди | ||||
| 1. | 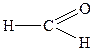
| Мурашиний альдегід (формальдегід) | Метаналь | |
| 2. | 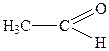
| Оцтовий альдегід (ацетальдегід) | Етаналь | |
| 3. | 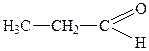
| Пропіоновий альдегід (пропіональдегід) | Пропаналь | |
| 4. | 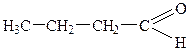
| Масляний альдегід (бутиральальдегід) | Бутаналь | |
| 5. | 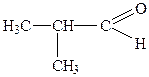
| Ізомасляний альдегід | 2-Метилпропаналь | |
| 6. | 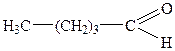
| Валеріановий альдегід | Пентаналь | |
| 7. | 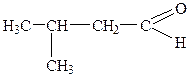
| Ізовалеріановий альдегід ( 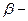 метилмасляний) метилмасляний)
| 3-Метилбутаналь | |
| 9. | 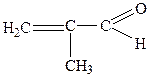
| Акриловий альдегід (акролеїн) | 2-Пропеналь | |
| 10. | 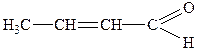
| Кротоновий альдегід | 2-Бутеналь | |
| 11. | 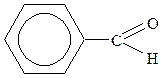
| Бензойний альдегід (бензальдегід) | ||
| 12. | 
| Толуїловий альдегід | ||
| Кетони | |||
| 1. | 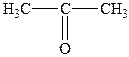
| Диметилкетон (ацетон) | Пропанон |
| 2. | 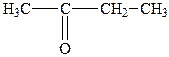
| Метилетилкетон | 2-Бутанон |
| 3. | 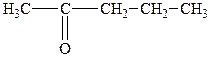
| Метилпропілкетон | 2-Пентанон |
| 4. | 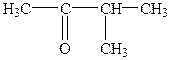
| Метилізопропілкетон | 3-Метил-2-бутанон |
| 5. | 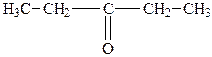
| Діетилкетон | 3-Пентанон |
| 6. | 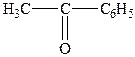
| Метилфенілкетон (ацетофенон) | |
| 7. | 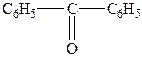
| Дифенілкетон (бензофенон) |
3. Способи добування альдегідів та кетонів жирного та ароматичного ряду
Способи добування карбонільних сполук: окиснення спиртів; дегідрування спиртів; відновлення галогенангідридів кислот (реакція Розенмунда); специфічне окиснення гомологів бензолу; термічний розклад солей карбонових кислот; гідроліз гемінальних дигалогенопохідних ; гідратація алкінів (реакція Кучерова); оксосинтез; безпосереднє введення альдегідної групи (реакція Гатермана-Коха); одержання ароматичних кетонів за реакцією Фріделя-Крафтса.
4. Фізичні властивості альдегідів та кетонів
Насичені альдегіди і кетони — це безбарвні рідини, крім метаналю, який за нормальних умов є газом. Температури кипіння альдегідів та кетонів нижчі, ніж у спиртів і кислот з тією ж кількістю атомів Карбону, тому що для них не характерний водневий зв’язок. Так, температура кипіння бутаналю (масляного альдегіду) становить +75,6°С, н-бутанолу — +117°С, бутанової (масляної) кислоти — +165°С. Кетони киплять за більш високих температур, ніж альдегіди з тією ж кількістю атомів Карбону.
Мурашиний і оцтовий альдегіди, як і ацетон, добре розчиняються у воді. Нижчі альдегіди мають різкий неприємний запах, деякі вищі альдегіди та кетони мають приємний запах. Альдегіди та деякі кетони приймають участь у формуванні смаку і аромату хліба, вина та ряду інших харчових продуктів.
ВЛАСТИВОСТІ АЛЬДЕГІДІВ І КЕТОНІВ
Лекція №11 (2 години)
План
1. Хімічні властивості альдегідів та кетонів.
2. Окремі представники.
3. Ненасичені оксосполуки.
4. Діальдегіди і дикетони.
Ключові слова: полярність оксогрупи, гідросульфітне похідне, напівацеталі, ацеталі, реактив Гріньяра, магній-органічний синтез, оксим, гідрозон, «реакція срібного дзеркала», фенілгідрозон, альдольна конденсація. акролеїн, хінон.
Література: [1] с. 159 - 176; [3] с. 283-298
1. Хімічні властивості альдегідів та кетонів
Хімічні властивості оксосполук обумовлені наявністю функціональної групи – карбонільної. Електронна будова карбонільної групи (σ- та π-зв’язки).
Реакції приєднання
Хімічні властивості пов’язані з полярністю оксогрупи, яка обумовлює реакції нуклеофільного приєднання (  ). Так приєднуються: водень (реакція відновлення), синильна кислота, натрій гідросульфіт, спирти (утворення напівацеталей та ацеталей).
). Так приєднуються: водень (реакція відновлення), синильна кислота, натрій гідросульфіт, спирти (утворення напівацеталей та ацеталей).
Реакції альдегідів зі спиртами
Взаємодією альдегідів з спиртами спочатку одержують неповні етери, так звані напівацеталі, які мають велике значення для вивчення властивостей вуглеводів і визначають ряд їх хімічних перетворень.
Нагрівання альдегідів із надлишком спирту в присутності слідів мінеральних кислот призводить до утворення ацеталей. Ацеталі — приємно пахучі безбарвні рідини, добре розчинні в багатьох органічних розчинниках і погано у воді. Вони відіграють велику роль у процесах біосинтезу складних органічних сполук, приймають участь у формуванні запаху деяких харчових продуктів. Склад ацеталей вина значно впливає на його букет ароматів.
Реакції з магній-органічними сполуками
Альдегіди та кетони здатні приєднувати магній-органічні сполуки — реактиви Гріньяра. Одержані за цією реакцією продукти приєднання легко руйнуються водою з виділенням спиртів (магній-органічний синтез спиртів).
Реакції заміщення Оксигену оксогрупи
Реакції заміщення Оксигену оксогрупи з нітрогеновмісними сполуками: гідроксиламіном, гідразином, фенілгідразином:
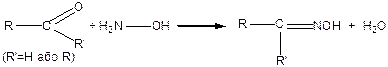
| ||
| Гідроксиламін | Оксим |
Оксими, гідразони або фенілгідразони гідролізуються водними розчинами кислот з утворенням вихідних сполук.
При дії галоїдних сполук фосфору на оксосполуки атом Оксигену в оксогрупі заміщується двома атомами галогену:
Реакції заміщення в радикалі
Внаслідок поляризації оксогрупи атоми Гідрогену в молекулах альдегідів і кетонів, що знаходяться в α-положенні, стають рухливими і здатними до реакцій заміщення під дією галогенів:
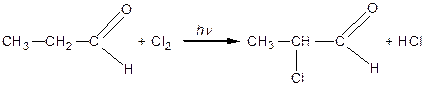
| |
| Пропіоновий альдегід | a-хлорпропіоновий альдегід |
Реакції заміщення в ароматичних альдегідах
Для ароматичних альдегідів взаємодія з галогенами відбувається за різними схемами залежноі від умов реакції:
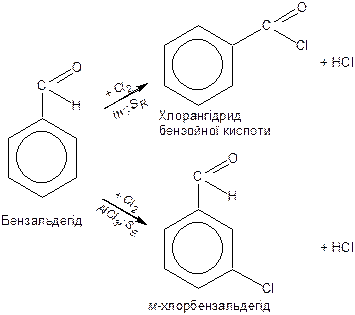
|
Для ароматичних альдегідів і кетонів реакції заміщення в кільці відбуваються в мета-положенні через те, що групи
є орієнтантами другого роду.
Реакції окиснення альдегідів
Альдегіди легко окиснюються до карбонових кислот із тим же числом атомів Карбону. Окисниками виступають: кисень повітря, аміачний розчин аргентум(І) оксиду або купрум(ІІ) гідроксиду.
Реакцію альдегідів з аміачним розчином оксиду срібла називають «реакцією срібного дзеркала» – це якісна реакція на альдегіди.
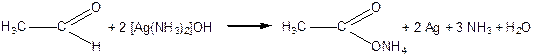
|
Якісною реакцією на альдегіди є реакція з купрум(ІІ) гідроксидом і реактивом Фелінга. В умовах нагрівання випадає осад купрум(І) оксиду червоного кольору.
Реакції окиснення кетонів
Кетони окиснюються більш сильними окисниками: концентрованою нітратною кислотою, калій перманганатом у кислому середовищі тощо. В результаті окиснення кетонів відбувається розрив карбонового ланцюга поряд із карбонільною групою з утворенням суміші кислот.
Реакції полімеризації та конденсації
Альдольна та кротонова конденсація. Реакція Канніццаро-Тищенко. Поліконденсація з фенолами, утворення феноло-формальдегідних смол.
2. Окремі представники
Мурашиний альдегід, оцтовий альдегід, бензальдегід, ванілін (n-окси-m-метокси-бензальдегід), ацетон, ацетофенон, циклогексанон тощо.
3. Ненасичені оксосполуки
Акролеїн, кетен, кротоновий альдегід, цитраль (3,7-диметил-2,6-октадієналь), коричний альдегід.
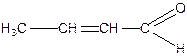
| 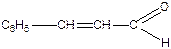
|
| Кротоновий альдегід | Коричний альдегід |
4. Діальдегіди і дикетони
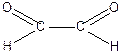
| 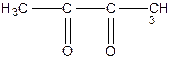
|
| Гліоксаль | Діацетил |
Хінони
Під час окиснення ароматичних двоатомних фенолів утворюються хінони:
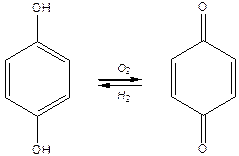
| ||
| Гідрохінон | n-бензохінон |
Хінонам характерна висока реакційна здатність. В результаті відновлення хінони легко перетворюються знову на двоатомні феноли.
Вітамін К (філохінон).
ОДНООСНОВНІ КАРБОНОВІ КИСЛОТИ ТА ЇХ ФУНКЦІОНАЛЬНІ ПОХІДНІ
Лекція №12 (2 години)
План
1. Загальна характеристика карбонових кислот.
2. Ізомерія, номенклатура одноосновних карбонових кислот.
3. Способи добування одноосновних карбонових кислот.
4. Фізичні властивості кислот.
5. Хімічні властивості кислот.
6. Окремі представники, їх значення і використання.
Ключові слова: карбонова кислота, одноосновна кислота, багатоосновна кислота, карбоксильна група, основність кислоти, ацильна група, гемінальні тригалогеналкани, нітрил кислоти, асоціація, димери, карбоксилат-іон, дисоціація, амід кислоти, ангідрид кислоти, галогенангідрид кислоти.
Література: [1] с. 177 - 199; [3] с. 375 – 388, 399 - 412
Дата добавления: 2015-04-03; просмотров: 3042;
