РАСЧЕТ ОСНОВНЫХ СВОЙСТВ СЖИЖЕННЫХ ГАЗОВ
Сжиженные газы, используемые для газоснабжения потребителей представляют собой технические пропан и бутан, а также их смеси. Для проектирования, строительства и эксплуатации систем газоснабжения необходимо знать физико-термодинамические свойства индивидуальных сжиженных газов и их смесей.
Плотность сжиженного газа определяется как масса единицы объема. При изменении температуры она меняется. Для технических расчетов плотность компонентов сжиженного газа можно определять по формуле
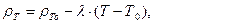 (5.1)
(5.1)
где λ - коэффициент температурного расширения, кг/(м3*К); Т0 - начальная температура, К; 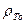 - плотность при начальной температуре, кг/м .
- плотность при начальной температуре, кг/м .
Плотность смеси сжиженных газов определяется
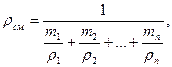 (5.2)
(5.2)
где m1 , m2 , …,mn - массовые доля компонентов( 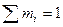 );
); 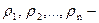 плотности компонентов, входящих в состав сжиженного газа.
плотности компонентов, входящих в состав сжиженного газа.
Удельный объем - величина обратная плотности. Жидкая фаза СУГа резко увеличивает свой объем при повышении температуры. Изменение объема определяют по формуле
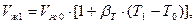 (5.3)
(5.3)
где Vж0 - объем жидкости при начальной температуре Т0,βТ - коэффициент объёмного расширения, 1/К.
Сжимаемость сжиженных газов по сравнению с другими жидкостями очень велика, поэтому это свойство следует обязательно учитывать при проектировании хранилищ сжиженных газов, а также при проектировании трубопроводов с большим перепадом давленая в начале и конце.
Изменение объема СУГа в зависимости от давления можно определить
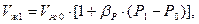 (5.4)
(5.4)
где βР - коэффициент объёмного сжатия, м3/Па.
Часто встречается понятие - модуль упругости жидкости (Е). Это величина, обратная βΡ, т.е. Ε=1/βΡ.
Вязкость сжиженного газа определяется величиной динамического коэффициента вязкости. Аналитически вязкость можно определять по уравнению Андраде-Панченков
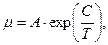 (5.5)
(5.5)
где А и С- экспериментальные коэффициенты; T-температура, К.
Для приближенного расчета вязкости смеси СУГа рекомендуется зависимость

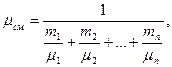 (5.6)
(5.6)
где m1 , m2 , …,mn - массовые доля компонентов( 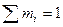 );
); 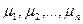 - динамические коэффициенты вязкости компонентов смеси, (Па*с).
- динамические коэффициенты вязкости компонентов смеси, (Па*с).
Кинематическая вязкость определяется из отношения ν = μ/ρ, м2/с.
Давление насыщенных паров сжиженных газов проявляется, когда система жидкость-пар находится в равновесии. Давление насыщенных паров — основная величина для расчета резервуаров, танкеров, цистерн, баллонов сжиженного газа, испарительной способности установок, а также состава газа в зависимости от климатических условий. Это важный параметр при расчете трубопроводов для сжиженных газов.
Упругость паров зависит от температуры и давления. Сжиженные газы обладают свойством взаимной растворимости и с достаточной точностью подчиняются закону Рауля. Упругость паров жидкой смеси (её давление) равна сумме парциальных (индивидуальных) давлений паров всех компонентов:
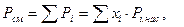 (5.7)
(5.7)
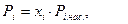 (5.8)
(5.8)
где Ρ, - парциальное давление паров компонента i, находящегося в жидкой смеси; xi - молярная доля компонента i в жидкой смеси; Pi.нас. - упругость паров чистого компонента i при температуре смеси.
Состав газовых смесей и смесей взаимно растворимых жидкостей задают молярными долями, массовыми и объемными долями. Для газов значение молярных и объемных концентраций одинаково.
При условии термодинамического равновесия для каждого компонента парциальное давление газа, находящегося над уровнем жидкости (в паровой фазе), равно давлению этого компонента в жидкой смеси.
По закону Дальтона парциальное давление паров компонента определяется
 (5.9)
(5.9)
где уi - молярная (объёмная) доля компонента в паровой фазе; Рсм - общее давление смеси.
Следовательно, можно записать
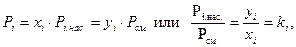 (5.10)
(5.10)
где ki - константа газового равновесия.
Зная константы и молярный состав жидкости, можно определить состав смеси равновесной паровой фазы при заданной температуре. Для большинства углеводородных газов величины констант равновесия найдены экспериментально.
Основные термодинамические параметры газов для технологических расчетов могут быть определены по диаграммам состояний Т - S (температура-энтропия), Ρ - J (давление-теплосодержание), J- S (теплосодержание-энтропия).Они строятся по экспериментальным данным, так как соотношения между основными термодинамическими параметрами реальных газов не подчиняются законам идеальных газов.
Дата добавления: 2015-04-21; просмотров: 5288;
