Применение первого начала термодинамики к изопроцессам
Для равновесных изопроцессов в газах уравнение первого начала термодинамики (dQ = dU + dА) имеет вид:
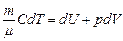 .
.
· Первое начало термодинамики при изохорическом процессе (V=const; dV=0, dA=pdV=0): 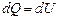 – теплота, сообщаемая системе при изохорическом процессе, идет на изменение внутренней энергии.
– теплота, сообщаемая системе при изохорическом процессе, идет на изменение внутренней энергии.
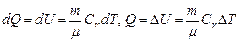 ,
,
При этом работа не совершается.
· Первое начало термодинамики при изобарическом процессе (p=const):
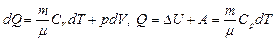 .
.
Работа изобарного расширения равна
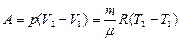 .
.
Сформулируем физический смысл универсальной газовой постоянной.
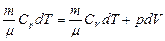 .
.
Для изобарического процесса (с учетом уравнения Менделеева-Клапейрона) 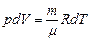 . Поэтому
. Поэтому 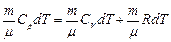 , или
, или
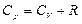 .
.
Универсальная газовая постоянная численноравна работе, которую необходимо совершить, чтобы нагреть 1 моль вещества на 1 К при постоянном давлении.
· Первое начало термодинамики при изотермическом процессе (Т=const; dT=0; 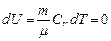 ):
): 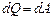 – теплота, сообщаемая системе при изотермическом процессе, идет на работу против внешних сил:
– теплота, сообщаемая системе при изотермическом процессе, идет на работу против внешних сил:
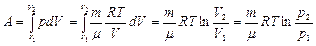
Итак, работа при изотермическом процессе:
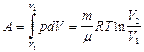 .
.
Изменение внутренней энергии dU=0, поэтому теплоемкость системы равна бесконечности.
Если газ изотермически расширяется (V2>V1), то к нему подводится тепло, и он совершает положительную работу. Если же газ изотермически сжимается (V2<V1), то он совершает отрицательную работу (то есть над ним совершают работу внешние силы).
Дата добавления: 2015-04-19; просмотров: 1057;
