Аккумуляторная батарея 20НКБН-25
Назначение и устройство. Аккумуляторная батарея 20НКБН-25 (20 — число элементов, НК — никель-кадмиевая, Б—батарея, Н—намазная, 25 — емкость в ампер-часах) служит дополнительным источником электрической энергии на самолете. Кроме того, аккумулятор служит для запуска двигателя и питания бортовой сети в случае отказа генератора и для, работы в полете в буферном режиме с генератором. Щелочная аккумуляторная батарея установлена в центроплане справа (см. рис. 2).
Батарея составлена из 20 аккумуляторов, соединенных последовательно шинами (рис. 76). Сосуд аккумулятора изготовлен из пластмассы. Внутри сосуда помещены положительные и отрицательные пластины, разделенные эбонитовыми изоляционными палочками. Боковая изоляция предохраняет пластины от соприкосновения со стенками сосуда. Пробка прикрывает отверстие в аккумуляторе, служащее дли заливки его электролитом и для отвода газов.
Аккумуляторы помещены в корпус, выполненный из нержавеющей стали. На боковых стенках корпуса имеются смотровые окна для наблюдения за уровнем электролита. В качестве электролита в кадмиево-никелевом аккумуляторе применяется водный раствор едкого калия (КОН). Для улучшения работы аккумулятора в электролит добавляется едкий литий (LiOH).

|
Рис. 76. Щелочной аккумулятор
Рис. 77. Пластины щелочного аккумулятора
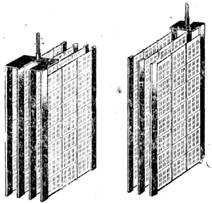
Положительные и отрицательные пластины кадмиево-нике-левого аккумулятора (рис. 77) состоят из отдельных стальных никелированных рам, в которые заделаны в виде ячеек пакетики из перфорированной стали с активной массой. В качестве активной массы положительных пластин применяется смесь из гидрата закиси никеля Ni(ОН)2, гидрата окиси никеля Ni(ОН)3 и некоторого количества графита (до 20%), увеличивающего электропроводимость массы. В качестве активной массы отрицательных пластин применяется смесь губчатого кадмия Cd с железом Fe (75—80% кадмия и 20—25% железа). Железо увеличивает электропроводимость массы и предохраняет ее от спе-кания.
Электрохимические процессы при заряде аккумулятора.При заряде анод аккумулятора присоединяется к положительному полюсу источника электрической энергии, а катод — к отрицательному полюсу.
В начале заряда аккумулятор представляет собой электрохимическую систему следующего состава:
Ni(ОН)2 |КОН| Cd(ОН)2
анод электролит катод
При подключении аккумулятора к источнику постоянного тока в цепи возникает электрический ток вследствие движения ионов.
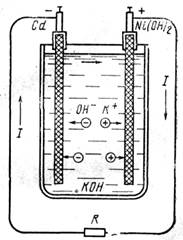
На рис. 78 показана принципиальная схема заряда аккумулятора. Под действием внешней разности потенциалов свободные электроны уходят с анода, одновременно отрицательные ионы гидроксила ОН попадают на анод и отдают ему свои отрицательные заряды. На аноде возникает химическая реакция, которая в молекулярном виде может быть записана так: 2Ni(ОН)2 + 2(ОН) = 2Ni(ОН)3. На отрицательном электроде происходит реакция: Cd(ОН)2->Cd+2(ОН), т. е. гидрат окиси кадмия Cd(ОН)2, в результате химической реакции распадается на губчатый кадмий Cd и гидроксил 2(ОН). Последний, вступая в химическое взаимодействие с калием, образует молекулы едкого кали: 2(ОН)+2К = 2КОН. Следовательно, уравнение токообразующего процесса при заряде кадмиево-ни-келевого аккумулятора можно записать в следующем виде:
Cd(ОН)2 + 2КОН + 2Ni(ОН)2 = Cd2КОН + 2Ni(ОН)3,
катод анод анод
т. е. в результате на катоде восстанавливается губчатый кадмий, а на аноде — гидрат окиси никеля 2Ni(ОН)3.
Электрохимические процессы при разряде аккумулятора. Заряженный аккумулятор представляет собой электрическую схему, где активным веществом анода является гидрат окиси никеля Ni(ОН)з, активной массой катода—губчатый (пористый) кадмий Cd и электролитом раствор едкого кали КОН. В электролите аккумулятора происходит непрерывный процесс электролитической диссоциации молекул: КОН<>К+ + ОН-.
|
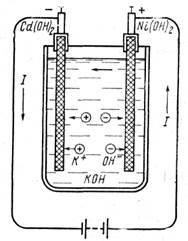
Рис. 78. Схема заряда кадмиевоникелевого аккумулятора Рис. 79. Схема разряда кадмиевоникелевого аккумулятора
При подсоединения к зажимам аккумулятора нагрузки в цепи возникает электрический ток, и аккумулятор начинает разряжаться.
Принципиальная схема разряда кадмиево-никелевого аккумулятора показала на рис. 79. Положительные ионы калия К перемещаются в направлении электрического поля, т. е. от отрицательного электрода к положительному. Отрицательные ионы гидроксила ОН перемещаются навстречу электрическому полю, т. е. от анода к катоду. С отрицательного электрода электроны уходят во внешнюю цепь. Отрицательные ионы гидроксильной группы ОН отдают свои отрицательные заряды катоду и в результате этого там возникает химическая реакция Cd + 2ОН = = Cd(ОН)3, т. е. образуется гидрат окиси кадмия Cd (ОН)2.
Из внешней цепи на анод поступают свободные электроны, а из электролита — положительные ионы калия К+, которые отдают аноду свои положительные заряды. В результате на аноде возникает следующая реакция: 2Ni(ОН)3 + 2К = = 2Ni(ОН)2+2КОН, т. е. при разряде аккумулятору на аноде образуется гидрат закиси никеля Ni(ОН)2 и едкий кали КОН. Следовательно, уравнение токообразующего процесса при разряде кадмиево-никелевого акумулятора можно записать так:
2Ni(ОН)3 + 2КОН + Cd = 2Ni(ОН)2 + 2КОН + Cd(ОН)2.
анод катод анод катод
Концентрация электролита при разряде и заряде аккумулятора не изменяется, так как сколько едкого кали расходуется вблизи катода, столько же его возникает вблизи анода.
Дата добавления: 2015-04-19; просмотров: 11144;
