Энтропия. Как уже указывалось, величина не является полным дифференциалом
Как уже указывалось, величина 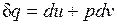 не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т. е. процесс, который совершает газ.
не является полным дифференциалом. Действительно, для того чтобы проинтегрировать правую часть этого выражения, нужно знать зависимость р от v, т. е. процесс, который совершает газ.
В математике доказывается, что дифференциальный двучлен всегда можно превратить в полный дифференциал путем умножения (или деления) на интегрирующий множитель (или делитель). Таким интегрирующим делителем для элементарного количества теплоты q является абсолютная температура Т.
Покажем это на примере изменения параметров идеального газа в равновесных процессах:
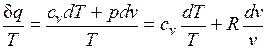 . (3.3)
. (3.3)
Выражение 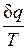 при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж/(кгК). Для произвольного количества газа энтропия, обозначаемая через S, равна S=Ms и измеряется в Дж/К.
при равновесном изменении состояния газа есть полный дифференциал некоторой функции состояния. Она называется энтропией, обозначается для 1 кг газа через s и измеряется в Дж/(кгК). Для произвольного количества газа энтропия, обозначаемая через S, равна S=Ms и измеряется в Дж/К.
Таким образом, аналитически энтропия определяется следующим образом:
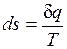 . (3.4)
. (3.4)
Формула (3.4) справедлива как для идеальных газов, так и для реальных тел. Подобно любой другой функции состояния энтропия может быть представлена в виде функции любых двух параметров состояния:
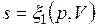 ;
; 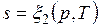 ;
; 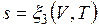 .
.
Значение энтропии для заданного состояния определяется интегрированием уравнения (3.4):
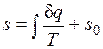
где 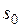 — константа интегрирования.
— константа интегрирования.
При температурах, близких к абсолютному нулю, все известные вещества находятся в конденсированном состоянии. В. Нернст (1906 г.) экспериментально установил, а М. Планк (1912 г.) окончательно сформулировал следующий принцип: при температуре , стремящейся к абсолютному нулю, энтропия вещества, находящегося в конденсированном состоянии с упорядоченной кристаллической структурой, стремится к нулю, т. е. s0 = 0 при Т = 0 К. Этот закон называют третьим законом термодинамики или тепловой теоремой Нернста. Он позволяет рассчитать абсолютное значение энтропии в отличие от внутренней энергии и энтальпии, которые всегда отсчитываются от произвольного уровня.
Однако в технической термодинамике обычно используется не абсолютное значение энтропии, а ее изменение в каком-либо процессе:
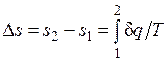 ,
,
поэтому энтропию тоже часто отсчитывают от произвольно выбранного уровня.
Получим формулы, позволяющие вычислить изменение энтропии идеального газа. Для этого проинтегрируем уравнение (3.3), положив для простоты cv= const:
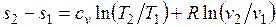 . (3.5)
. (3.5)
Из уравнения Клапейрона, записанного для состояний 1 и 2, следует:
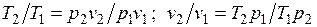 .
.
После подстановки отношений и в выражение (3.4) получим следующие формулы для изменения энтропии идеального газа:
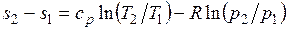 ;
;
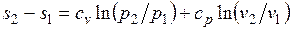 . (3.6)
. (3.6)
Поскольку энтропия есть функция состояния рабочего тела, уравнениями (3.5) — (3.6) можно пользоваться вне зависимости от пути перехода рабочего тела между состояниями 1 и 2 и, в частности, от того, равновесный этот переход или нет.
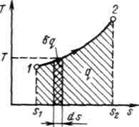
Рисунок 3.2 - Графическое изображение теплоты в T, s – координатах
Понятие энтропии позволяет ввести чрезвычайно удобную для термодинамических расчетов Т, s-диаграмму, на которой (как и на p,v -диаграмме) состояние термодинамической системы изображается точкой, а равновесный термодинамический процесс линией (Рисунок 3.2).
В равновесном процессе
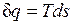 ;
;
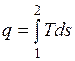 .
.
Очевидно, что в Т, s-диаграмме элементарная теплота процесса 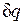 изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
изображается элементарной площадкой с высотой Т и основанием ds, а площадь, ограниченная линией процесса, крайними ординатами и осью абсцисс, эквивалентна теплоте процесса.
Формула 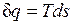 показывает, что ds и
показывает, что ds и 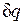 имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу (
имеют одинаковые знаки, следовательно, по характеру изменения энтропии в равновесном процессе можно судить о том, в каком направлении происходит теплообмен. При подводе теплоты к телу ( 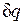 >0) его энтропия возрастает (ds>0), а при отводе теплоты (
>0) его энтропия возрастает (ds>0), а при отводе теплоты ( 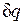 <0) — убывает (ds<0).
<0) — убывает (ds<0).
Дата добавления: 2015-04-19; просмотров: 974;
