Смеси идеальных газов
Все зависимости, полученные выше для идеальных газов, справедливы и для их смесей, если в них подставлять газовую постоянную, молекулярную массу и теплоемкость смеси.
Закон Дальтона.В инженерной практике часто приходится иметь дело с газообразными веществами, близкими по свойствам к идеальным газам и представляющими собой механическую смесь отдельных компонентов различных газов, химически не реагирующих между собой. Это так называемые газовые смеси. В качестве примера можно назвать продукты сгорания топлива в двигателях внутреннего сгорания, топках печей и паровых котлов, влажный воздух в сушильных установках и т. п.
Основным законом, определяющим поведение газовой смеси, является закон Дальтона: полное давление смеси идеальных газов равно сумме парциальных давлений всех входящих в нее компонентов:
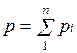
Парциальное давление pi — давление, которое имел бы газ, если бы он один при той же температуре занимал весь объем смеси.
Способы задания смеси.Состав газовой смеси может быть задан массовыми, объемными или мольными долями.
Массовой долей называется отношение массы отдельного компонента Мi, к массе смеси М:
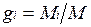 .
.
Очевидно, что 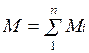
 и
и 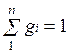 .
.
Массовые доли часто задаются в процентах. Например, для сухого воздуха 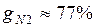 ;
; 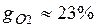 .
.
Объемная доля представляет собой отношение приведенного объема газа V, к полному объему смеси V: 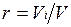 .
.
Приведенным называется объем, который занимал бы компонент газа, если бы его давление и температура равнялись давлению и температуре смеси.
Для вычисления приведенного объема запишем два уравнения состояния i-го компонента:
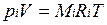 ; (2.1)
; (2.1)
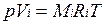 .
.
Первое уравнение относится к состоянию компонента газа в Смеси, когда он имеет парциальное давление pi и занимает полный объем смеси, а второе уравнение — к приведенному состоянию, когда давление и температура компонента равны, как и для смеси, р и Т. Из уравнений следует, что
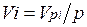 . (2.2)
. (2.2)
Просуммировав соотношение (2.2) для всех компонентов смеси, получим с учетом закона Дальтона 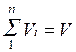 ,откуда
,откуда 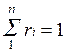 . Объемные доли также часто задаются в процентах. Для воздуха
. Объемные доли также часто задаются в процентах. Для воздуха 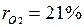 ,
, 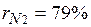 .
.
Иногда бывает удобнее задать состав смеси мольными долями. Мольной долей называется отношение количества молей Ni рассматриваемого компонента к общему количеству молей смеси N.
Пусть газовая смесь состоит из N1 молей первого компонента, N2 молей второго компонента и т. д. Число молей смеси 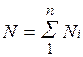 , а мольная доля компонента будет равна
, а мольная доля компонента будет равна 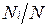 .
.
В соответствии с законом Авогадро объемы моля любого газа при одинаковых р и Т, в частности при температуре и давлении смеси, в идеально газовом состоянии одинаковы. Поэтому приведенный объем любого компонента может быть вычислен как произведение объема моля 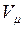 на число молей этого компонента, т. е.
на число молей этого компонента, т. е. 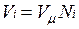 а объем смеси — по формуле
а объем смеси — по формуле 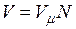 . Тогда
. Тогда 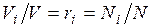 , и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
, и, следовательно, задание смесильных газов мольными долями равно заданию ее объемными долями.
Газовая постоянная смеси газов. Просуммировавуравнения (2.1) для всех компонентов смеси, получим 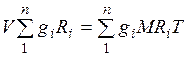 . Учитывая
. Учитывая 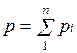 , можно записать
, можно записать
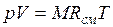 , (2.3)
, (2.3)
где
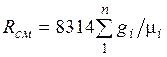 . (2.4)
. (2.4)
Из уравнения (2.3) следует, что смесь идеальных газов также подчиняется уравнению Клапейрона. Поскольку 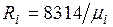 то из (2.4) следует, что газовая постоянная смеси [Дж/(кг-К)] имеет вид
то из (2.4) следует, что газовая постоянная смеси [Дж/(кг-К)] имеет вид
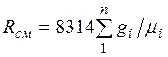 (2.5)
(2.5)
Кажущаяся молекулярная масса смеси. Выразим формально газовую постоянную смеси R, введя кажущуюся окулярную массу смеси 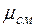 :
: 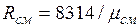 (2.6)
(2.6)
Сравнивая правые части соотношений (2.5) и (2.6), найдем
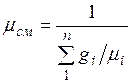 .
.
Изопределения массовых долей следует, что
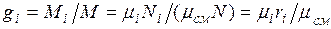
Просуммировав это соотношение для всех компонентов и учитывая, что 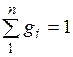 , получим выражение для кажущейся молекулярной и массы смеси, заданной объемными долями:
, получим выражение для кажущейся молекулярной и массы смеси, заданной объемными долями:
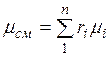 . (2.7)
. (2.7)
Соотношение между объемными и массовыми долями. Учитывая (2.7), получаем 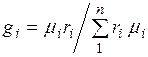 .
.
Поскольку 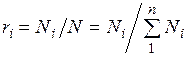 , то
, то
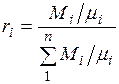
Разделив числитель и знаменатель этой формулы на массу смеси М, получим
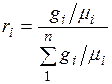 .
.
Аналитическое выражение первого закона термодинамики
Первый закон термодинамики представляет собой частный случай всеобщего закона сохранения и превращения энергии применительно к тепловым явлениям. В соответствии с уравнением Эйнштейна 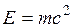 надо рассматривать единый закон сохранения и превращения массы и энергии. Однако в технической термодинамике мы имеем дело со столь малыми скоростями объекта, что дефект массы равен нулю, и поэтому закон сохранения энергии можно рассматривать независимо.
надо рассматривать единый закон сохранения и превращения массы и энергии. Однако в технической термодинамике мы имеем дело со столь малыми скоростями объекта, что дефект массы равен нулю, и поэтому закон сохранения энергии можно рассматривать независимо.
Закон сохранения и превращения энергии является фундаментальным законом природы, который получен на основе обобщения огромного количества экспериментальных данных и применим ко всем явлениям природы. Он утверждает, что энергия не исчезает и не возникает вновь, она лишь переходит из одной формы в другую, причем убыль энергии одного вида дает эквивалентное количество энергии другого вида.
В числе первых ученых, утверждавших принцип сохранения материи и энергии, был наш соотечественник М. В. Ломоносов (1711 — 1765 гг.).
Пусть некоторому рабочему телу с объемом V и массой М, имеющему температуру Т и давление р, сообщается извне бесконечно малое количество теплоты 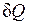 . В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV.
. В результате подвода теплоты тело нагревается на dT и увеличивается в объеме на dV.
Повышение температуры тела свидетельствует об увеличении кинетической энергии его частиц. Увеличение объема тела приводит к изменению потенциальной энергии частиц. В результате внутренняя энергия тела увеличивается на dU. Поскольку рабочее тело окружено средой, которая оказывает на него давление, то при расширении оно производит механическую работу 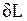 против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
против сил внешнего давления. Так как никаких других изменений в системе не происходит, то по закону сохранения энергии
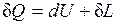 (2.8)
(2.8)
т. е. теплота, сообщаемая системе, идет на приращение ее внутренней энергии и на совершение внешней работы.
Полученное уравнение является математическим выражением первого закона термодинамики. Каждый из трех членов этого соотношения может быть положительным, отрицательным или равным нулю. Рассмотрим некоторые частные случаи.
1. 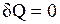 — теплообмен системы с окружающей средой отсутствует, т. е. теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется адиабатным. Для него уравнение (2.8) принимает вид:
— теплообмен системы с окружающей средой отсутствует, т. е. теплота к системе не подводится и от нее не отводится. Процесс без теплообмена называется адиабатным. Для него уравнение (2.8) принимает вид:
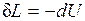 .
.
Следовательно, работа расширения, совершаемая системой в адиабатном процессе, равна уменьшению внутренней энергии данной системы. При адиабатном сжатии рабочего тела затрачиваемая извне работа целиком идет на увеличение внутренней энергии системы.
2. 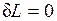 — при этом объем тела не изменяется, dV=0 . Такой процесс называется изохорным, для него
— при этом объем тела не изменяется, dV=0 . Такой процесс называется изохорным, для него
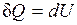 ,
,
т. е. количество теплоты, подведенное к системе при постоянном объеме, равно увеличению внутренней энергии данной системы.
3. dU=0 – внутренняя энергия системы не изменяется и
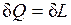 ,
,
т.е. сообщаемая системе теплота превращается в эквивалентную ей внешнюю работу.
Для системы, содержащей 1 кг рабочего тела
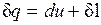 . (2.9)
. (2.9)
Проинтегрировав уравнения (2.8) и (2.9) для некоторого процесса, получим выражение первого закона термодинамики в интегральной форме:
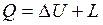 ;
; 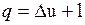 .
.
ЛЕКЦИЯ 3
Внутренняя энергия
Внутренняя энергия системы включает в себя:
кинетическую энергию поступательного, вращательного и колебательного движения частиц;
потенциальную энергию взаимодействия частиц;
энергию электронных оболочек атомов;
внутриядерную энергию.
В большинстве теплоэнергетических процессов две последние составляющие остаются неизменными. Поэтому в дальнейшем под внутренней энергией будем понимать энергию хаотического движения молекул и атомов, включающую энергию поступательного, вращательного и колебательного движений как молекулярного, так и внутримолекулярного, а также потенциальную энергию сил взаимодействия между молекулами.
Кинетическая энергия молекул является функцией температуры, значение потенциальной энергии зависит от среднего расстояния между молекулами и, следовательно, от занимаемого газом объема V, т. е. является функцией V. Поэтому внутренняя энергия U есть функция состояния тела.
Для сложной системы она определяется суммой энергий отдельных частей, т. е. обладает свойством аддитивности. Величина и=U/М, называемая удельной внутренней энергией (Дж/кг), представляет собой внутреннюю энергию единицы массы вещества.
В дальнейшем для краткости будем называть величину и просто внутренней энергией. Поскольку внутренняя энергия есть функция состояния тела, то она может быть представлена в виде функции двух любых независимых параметров, определяющих это состояние:
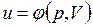 ;
; 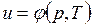 ;
; 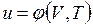 .
.
Ее изменение в термодинамическом процессе 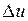 не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
не зависит от характера процесса и определяется только начальным и конечным состояниями тела:
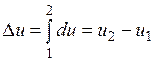 ;
;
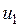 — значение внутренней энергии в начальном состоянии, а
— значение внутренней энергии в начальном состоянии, а 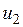 — в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
— в конечном. Математически это означает, что бесконечно малое изменение внутренней энергии du есть полный дифференциал и; если выразить внутреннюю энергию в виде функции удельного объема и температуры, то
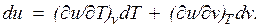
Внутренняя энергия идеального газа, в котором отсутствуют силы взаимодействия между молекулами, не зависит от объема газа или давления 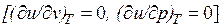 , а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
, а определяется только его температурой, поэтому производная от внутренней энергии идеального газа по температуре есть полная производная:
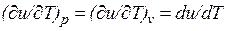
Для задач технической термодинамики важно не абсолютное значение внутренней энергии, а ее изменение в различных термодинамических процессах. Поэтому начало отсчета внутренней энергии может быть выбрано произвольно. Например, в соответствии с международным соглашением для воды за нуль принимается значение внутренней энергии при температуре 0,01 °С и давление 610,8 Па, а для идеальных газов — при 0 °С вне зависимости от давления.
Дата добавления: 2015-04-19; просмотров: 1463;
