Механизм реакции
Сульфированию предшествует образование электрофильного реагента HSO+3 - гидросульфониевого иона:
3H2SO4 → Н3О+ + HSO+3 + 2HSO-4
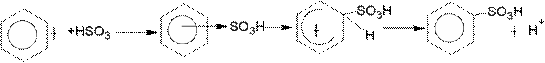
π-комплекс σ-комплекс
H+ + HSO-4 → H2SO4
Еще более активным электрофильным реагентом является триоксид серы, в котором имеется дефицит электронной плотности на атоме серы:
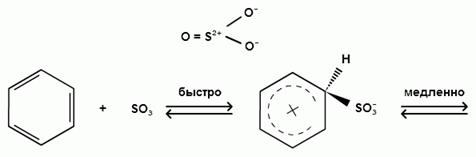
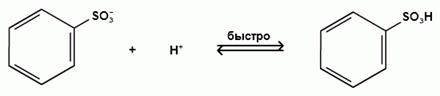
σ- комплекс
биполярный ион
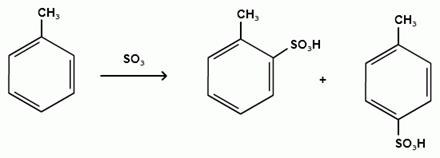
Гомологи бензола сульфируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами:
1.3. Реакции галогенирования.
В присутствии катализаторов кислот Льюиса (AlCl3; AlBr3; FeCl3; FeBr3; ZnCl2)при комнатной температуре происходит замещение атомов водорода бензольного ядра на атомы галогена:
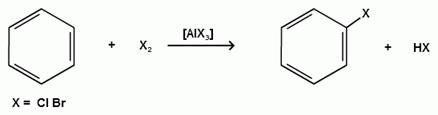
Причем хлор замещает водород в ароматическом ядре активнее брома, а осуществить иодирование и фторирование аренов практически не удается, вследствие недостаточной активности иода и чрезмерной активности фтора.
Роль катализатора заключается в образовании или положительного иона галогена или комплекса галогена с кислотой Льюиса с поляризацией связи галоген-галоген:
1) образование положительного иона галогена:
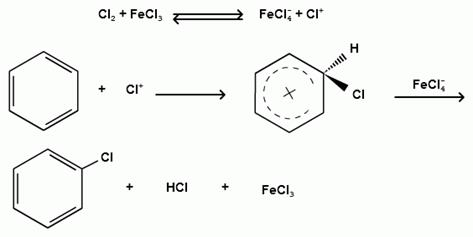
2) образование комплекса галогена с кислотой Льюиса с поляризацией связи галоген-галоген:
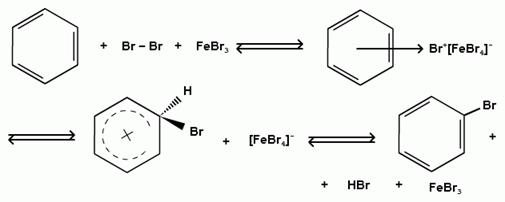
Дальнейшее галогенирование происходит с трудом, так как галогены затрудняют реакции с электрофильными реагентами, но являются орто- и пара-ориентантами:
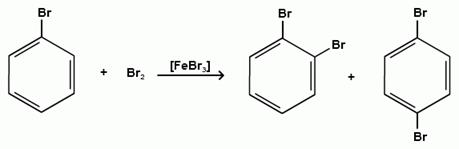
бромбензол 1,2-дибромбензол 1,4-дибромбензол
Гомологи бензола галогенируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами:
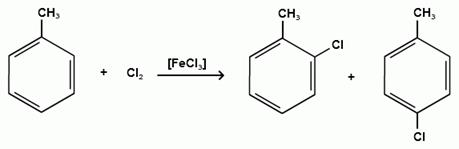
толуол орто-хлортолуол пара-хлортолуол
1.4. Реакции алкилирования по Фриделю-Крафтсу.
Бензол и его гомологи в присутствии катализаторов кислот Льюиса (AlCl3; AlBr3; FeCl3; FeBr3; ZnCl2)легко алкилируются галогеналканами:

Катализатор кислота Льюиса при взаимодействии с галогеналканами образует или карбокатион, или комплекс галогеналкана с кислотой Льюиса с поляризацией связи углерод-галоген:
1) образование карбокатиона:
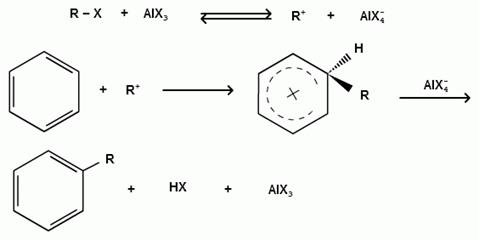
2) образование комплекса галогеналкана с кислотой Льюиса с поляризацией связи углерод-галоген:
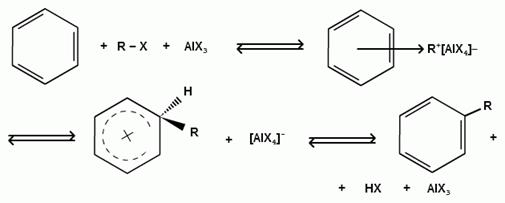
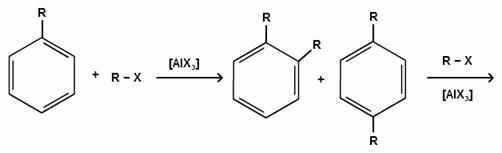
При алкилировании бензола первичными или вторичными галогеналканами образуется смесь изомерных алкилбензолов:
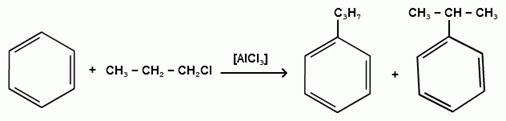
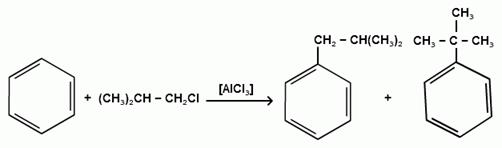
Это объясняется переходом менее устойчивого первичного карбокатиона в более устойчивый вторичный, а при соответствующих структурах - в более устойчивый третичный карбокатион.
+
СН3-СН2-СН2Cl + AlCl3 → CH3-CH2-CH+2 ↔ CH3-CH-CH3 + AlCl-4
+
 (СН3)2СН-СН2Cl + AlCl3 → (CH3)2CH-CH+2 ↔ CH3-C-CH3 + AlCl-4
(СН3)2СН-СН2Cl + AlCl3 → (CH3)2CH-CH+2 ↔ CH3-C-CH3 + AlCl-4
CH3
Для алкилирования аренов можно использовать также алкены и спирты в присутствии катализаторов - протонных кислот ( HF; H2SO4; H3PO4и др.)

Гомологи бензола алкилируются легче, чем бензол, так как алкильные группы являются заместителями первого рода и облегчают течение реакций с электрофильными реагентами:
1.5. Реакции ацилирования по Фриделю-Крафтсу.
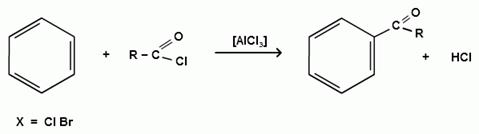
Бензол и его гомологи в присутствии катализаторов кислот Льюиса (AlCl3; AlBr3; FeCl3; FeBr3; ZnCl2)легко ацилируются галогенангидридами с образованием ацилпроизводных - ароматических кетонов:
Катализатор кислота Льюиса поляризует молекулу ацилгалогенида, тем самым увеличивая ее электрофильность:
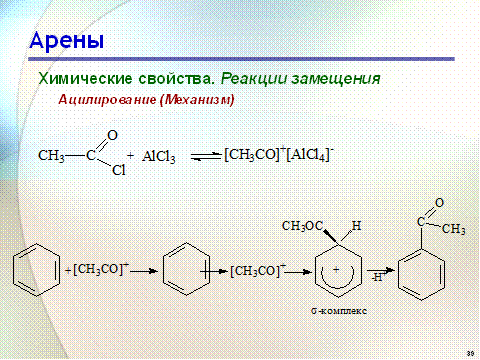
Реакция обычно ограничивается образованием моноацилпроизводных и не сопровождается перегруппировками в боковой цепи.
Дата добавления: 2015-04-15; просмотров: 2343;
