ПРИНЦИПИАЛЬНАЯ ПАТОГЕНЕТИЧЕСКАЯ СХЕМА ДВС-СИНДРОМА
[LEVI M., 1999]
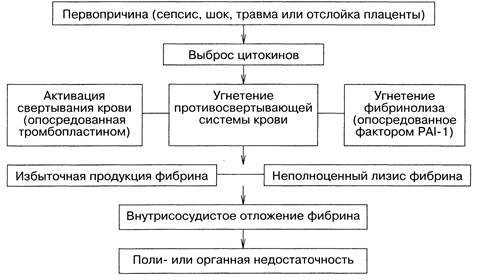
впоследствии полиорганная недостаточность (схема 35.1).
Клинически и лабораторно очевидный ДВС-синдром находят у 30—50 % больных с септическим шоком. При этом этиология шока (грамположительный или грамотри-цательный возбудитель) не отражается на частоте развития ДВС-син-дрома;
2) травматические: тяжелая черепно-мозговая травма, политравма, ожоги. Это вторая по распространенности причина ДВС-син-дрома, обязанная своим происхождением попаданию в системный кровоток разрушенного тканевого материала (тканевый и плазменный тромбопластин, жиры, фосфолипи-ды, продукты гемолиза и др.). Присущее этим веществам суммарное прокоагулянтное действие может превысить естественный антикоагу-лянтный потенциал крови. Неполноценности противосвертывающей и фибринолитической систем крови способствуют также цитокины, высвобождаемые в кровоток при тяже-
лой травме в рамках все той же системной воспалительной реакции.
Признаки ДВС-синдрома находят у 50—70 % больных с тяжелой травмой. Полагают, что присоединение коагулопатии увеличивает летальность при травмах по меньшей мере в 2 раза;
3) онкологические: гемобластозы (острый миелолейкоз), слизепроду-цирующая аденокарцинома поджелудочной или предстательной железы.
Механизм появления ДВС всего лишь у 15—20 % больных с подобной патологией не ясен. Большинство исследователей связывают развитие ДВС-синдрома в этих случаях с избыточной экспрессией тромбо-пластина на клеточной поверхности злокачественных клеток или избыточным внутриклеточным содержанием веществ с тромбопластинпо-добной активностью. Гибель опухолевых клеток (спонтанно или под влиянием химиотерапии) приводит к высвобождению этих веществ в системный кровоток;
4) акушерские: (пре- или эклампсия, отслойка плаценты, эмболия амниотической жидкостью.
ДВС-синдром при акушерской патологии обязан своим происхождением попаданию тромбопластин-подобного материала из плацентарной системы в кровеносное русло матери. Подобный вывод основан на многочисленных наблюдениях прямой корреляции степени отслойки плаценты с тяжестью сопутствующей коагулопатии. Показано in vitro наличие у амниотической жидкости выраженной прокоагу-лянтной активности;
5) трансфузионные: аппаратный гемолиз, массивные переливания донорской крови, реинфузия частично лизированной или инфицированной крови.
Клиническая картина. Сердечно-сосудистая система. Расстройства кровообращения аналогичны таковым при гиповолемии. Развиваются артериальная гипотен-зия, тахикардия, периферическая вазоконстрикция. Появляются признаки органной гипоперфузии (оли-гурия, нарушение сознания). В тяжелых случаях симптоматика соответствует типичному геморрагическому шоку. На клапанах сердца, в магистральных и мелких венозных стволах образуются тромбы. Возможны инсульты, инфаркты различной локализации.
Пищеварительная система. Возникают множественные язвы на слизистой оболочке на всем протяжении ЖКТ. Они чаще всего служат источником массивного кровотечения, угрожающего жизни. Накопление крови в просвете кишечника приводит к парезу, тяжелой интоксикации.
Урогениталъная система. Характерно повреждение почек — от легкой нефропатии до анурии. Именно этот орган проявляет наибольшую чувствительность к отложению фибрина в его микроциркуляторном русле. Если страдает только канал ь-
цевый аппарат почки (острый канал ьцевый некроз), то почечная недостаточность обычно носит обратимый характер. Если же повреждение распространяется и на клубочки (острый корковый некроз), ситуация становится инкурабельной.
Кожные покровы. Поражения кожи, как правило, обширны и представлены петехиями (элементы сыпи диаметром менее 3 мм). Иногда наблюдают «молниеносную пурпуру», когда в течение нескольких часов на обширных участках кожи появляются множественные экхи-мозы (элементы сыпи диаметром более 3 мм). Возможно развитие очагов кожного некроза и гангрены конечностей. Типичны также глубокие подкожные гематомы. Операционная рана, если таковая имеется, представляет собой дополнительный источник кровотечения.
Дыхательная система. Характерно поражение легких по типу РДСВ. Возможны рецидивирующая ТЭЛА, инфаркт-пневмония. Слизистая оболочка ТБД при контакте с брон-хоскопом или катетером для отсасывания мокроты обильно кровоточит. Типичны также спонтанные носовые кровотечения.
ЦНС. Наблюдают неспецифические нарушения сознания — от легкой оглушенности до комы. Очаговая неврологическая симптоматика, как правило, отсутствует.
Лабораторная диагностика. Данные лабораторных методов исследования служат лишь дополнением к клинической картине ДВС и ни в коем случае не заменяют ее. Следует помнить, что нет четко определенных, формализованных критериев диагноза ДВС и что оценка характера и тяжести нарушений свертывающей системы крови должна основываться на совокупности многочисленных лабораторных тестов (табл. 35.1):
1) определение D-димера — наиболее специфичный тест в отношении ДВС. D-димер представляет собой
Таблица 35.1. Лабораторная диагностика ДВС-синдрома [Merck, 1999]
| Показатель | Результат | Причина |
| Мазок периферической крови | Фрагментированные эритроциты | Рассечение эритроцитов фибриновы-ми нитями |
| Содержание тромбоцитов | Низкое (обычно менее 100,0-109/л) | Потребление тромбоцитов |
| Протромбиновое время (ПВ) F V / | Удлинено | Потребление II и IV факторов свертывания |
| АЧТВ | » | Потребление II, V и VIII факторов свертывания |
| ТромГиновое время (ТВ) | » | Низкое содержание II фактора свертывания и высокий уровень ПДФ |
| Содержание фибриногена | Низкое или высокое | Потребление в процессе тромбообра-зования или выброс в острой фазе воспаления (травмы) |
| Продукты деградации фибрина | Нормальное или высокое | Активный процесс вторичного фиб-ринолиза |
| Креатинин крови Общий анализ мочи | Повышен Изменен | Внутрисосудистое отложение фибрина в органах-мишенях (почки) |
один из продуктов деградации фибрина, и его появление в кровотоке указывает на растворение уже состоявшегося тромба (вторичный фибринолиз). Тест проводят с помощью моноклональных антител и считают положительным при титре >1:40.
2) продукты деградации фибриногена (ПДФ) появляются в кровотоке вследствие естественной биотрансформации фибриногена — предшественника фибрина. Подобный процесс может протекать перманентно, независимо от распространенного тромбообразования/кровотечения.
Уровень ПДФ повышен у 85— 100 % больных с ДВС. Такое повышение, однако, неспецифично и не может служить убедительным основанием для постановки диагноза ДВС-синдрома.
3) уровень фибриногена в плазме крови обычно бывает ниже 150 мг/дл. Следует, однако, иметь в виду, что фибриноген относится к белкам «острой фазы», поэтому его содержание может оказаться повышенным на начальной стадии ДВС-
синдрома. У беременных и больных с печеночной недостаточностью из-за исходно высокого уровня фибриногена его последующее снижение также может оказаться не очевидным;
4) содержание тромбоцитов, как правило, уменьшается (ниже уровня 100,0-109/л). Уровень тромбоцитов менее 50,0-109/л при ДВС-синдроме считают критическим. В мазке периферической крови при микроскопии находят крупные тромбоциты и Фрагментированные эритроциты («шизоциты»). Функциональная активность тромбоцитов заведомо нарушена и не требует специального изучения. Подобная гематологическая картина получила еще название микроангиопатического гемолиза;
5) время свертывания (ТВ и ПВ), активированное частичное тромбо-пластиновое время (А ЧТВ) относят к категории недостоверных критериев ДВС-синдрома. Эти показатели отражают в основном активность потребления II фактора свертывания — протромбина. Подобная активность оказывается увеличенной
при широком круге критической патологии, она неспецифична для ДВС-синдрома.
ДВС — это динамический процесс. Фаза гиперкоагуляции сменяется фазой гипокоагуляции (вследствие истощения факторов свертывания и активации фибри-нолиза), а затем фазой органных повреждений. Гиперкоагуляция, как правило, кратковременна и в клинической практике малозаметна.
Дифференциальный диагноз ДВС-синдрома. Выделяют подострую и острую («массивную») формы ДВС-синдрома. Обе формы заболевания имеют злокачественное течение, с трудом поддаются лечению и потенциально опасны для жизни.
Для подострого ДВС-синдрома кровотечения не характерны. В его клинической картине преобладают тромботические и тромбоэмболичес-кие осложнения, вызванные системной гиперкоагуляцией: венозные тромбозы, тромботические вегетации на створках сердечных клапанов, артериальные эмболии. Типичные лабораторные находки — умеренная тромбоцитопения, нормальное ПВ и нормальное содержание фибриногена, несколько укороченное АЧТВ, повышение уровня ПДФ.
Напротив, при остром ДВС-син-дроме возникают многочисленные очаги кровотечения: в зоне оперативного вмешательства, местах венозной или артериальной пункции, на слизистой оболочке ЖКТ и мочеполовых путей. Диссеминирован-ное внутрисосудистое отложение фибрина приводит также к ишеми-ческому повреждению почек, кожных и слизистых покровов, ЦНС. Эти повреждения в конечном итоге формируют полиорганную недостаточность.
Среди лабораторных находок обращают на себя внимание выражен-
ная (порой критическая) тромбоцитопения, значительное удлинение ПВ и АЧТВ, крайне низкое содержание фибриногена, появление в кровотоке высокого титра D-димера и ПДФ. Дополнительные тесты выявляют дефицит свертывающих и противосвертывающих факторов (в особенности V и VIII факторов, антитромбина III). B стеклянной пробирке такая кровь формирует едва заметный сгусток или не сворачивается вовсе.
Следует помнить, что типичные для ДВС-синдрома признаки -- ги-покоагуляция и тромбоцитопгния могут наблюдаться при гемодилю-ции (как следствие восполнения массивной кровопотери). Дифференциальный диагноз в этой ситуации проводят по содержанию D-димера и реакции на свежезамороженную плазму. При дилюционной коа-гулопатии D-димер не образуется, а при введении 1—2 доз свежезамороженной плазмы кровотечение, как правило, останавливается.
При гемолитическом уремическом синдроме, тромботической тромбо-цитопенической пурпуре, злокачественной артериальной гипертензии, HELLP-синдроме, агрессивной химиотерапии опухолей картина периферической крови («микроангиопа-тический гемолиз») полностью повторяет таковую при ДВС-синдроме. И хотя патогенетический механизм этого гемолиза специфичен (речь идет о первичном повреждении сосудистого эндотелия с последующей массивной пристеночной адгезией и агрегацией тромбоцитов), отличить его от ДВС-синдрома по клиническим и лабораторным проявлениям крайне затруднительно.
При тяжелой печеночной патологии (например, молниеносном вирусном гепатите) также возникает коагулопатия, обусловленная дефицитом синтеза факторов свертывания. Наличие желтухи и спленоме-галии помогает отличить такую коа-гулопатию от ДВС-синдрома.
Лечение. Отсутствие убедительных данных об эффективности какого-либо лечебного алгоритма при ДВС-синдроме превращает его терапию в своего рода искусство балансирования на грани возможного и недопустимого. Рекомендации по лечению ДВС-синдрома большей частью неопределенны и противоречивы. Выбор тех или иных медикаментозных средств: компонентов крови, антикоагулянтов или анти-фибринолитиков — ограничен многочисленными условиями и противопоказаниями, поэтому оптимальная тактика лечения в каждом конкретном случае определяется по принципу ex juvantibus, под постоянным мониторингом клинических и лабораторных показателей.
Устранение первопричины — ключевое условие лечения ДВС-синдрома. Следует помнить, что критическая коагулопатия в принципе неразрешима до тех пор, пока действуют ее пусковые механизмы. В большинстве случаев специфическая терапия ДВС-синдрома направлена на поддержание жизненно важных функций организма на то время, которое необходимо для коррекции первичной патологии (с помощью антибиотиков, операции и др.)· При устранении первопричины ДВС-синдром должен разрешиться самостоятельно.
Дата добавления: 2015-03-09; просмотров: 1096;
