Мотивационная характеристика темы.
Выделение в самостоятельное направление и развитие клинической фармакологии во второй половине ХХ века было мотивировано рядом обстоятельств, важнейшими из которых явились:
Ø бурное развитие фарминдустрии, повлекшее появление на фармацевтическом рынке десятков тысяч новых лекарств;
Ø осознание медицинской общественностью необходимости создания принципов применения лекарственных средств, строго регламентированных и основанных на научно доказанных фактах.
Господство эмпирической фармакотерапии, основанной на переносе экспериментальных данных фундаментальной фармакологии в клиническую практику, приводило к использованию малоэффективных и часто небезопасных препаратов и не позволяло оценивать отдаленный прогноз того или иного медикаментозного вмешательства. Более того, примат положения «кто хорошо диагностирует, тот хорошо лечит» явился причиной определенного парадокса в медицине — бурного развития методов диагностики с появлением десятков новых врачебных специальностей при практическом отсутствии надежных руководств по лечению больных в конкретных клинических ситуациях. Многочисленные справочники и монографии по фармакологии и фармакотерапии содержали (и содержат) сведения о химическом составе, механизмах действия лекарств, и неких усредненных правилах их применения.
В то же время, положение «лечить не болезнь, а больного» всегда было отличительной чертой отечественной медицинской школы и наиболее полно отвечало потребностям врачевания. Наконец, ряд трагедий, связанных с бесконтрольным применением медицинских препаратов (фокомиелия новорожденных при приеме талидомида беременными женщинами, случаи венозной тромбоэмболии, ассоциированные с применением гормональных оральных контрацептивов, нарушение биоценоза при активной терапии антибактериальными средствами и др.) обусловил выработку свода положений медицины, основанной на доказательствах. Эти и многие другие вопросы призвана решать клиническая фармакология, которая определяется как наука, изучающая взаимодействие лекарственного средства с организмом здорового и больного человека, и служит основой для проведения рациональной фармакотерапии. Под последней понимается «назначение больным лекарственных средств, соответствующих их клинической ситуации, в дозах, отвечающих индивидуальным потребностям, на адекватный период времени и по наименьшей стоимости для пациентов и общества» (ВОЗ). Таким образом, клиническая фармакология есть фармакология у постели больного.
Клиническая фармакология – это совокупность научно-обоснованных принципов рационального выбора ЛС для терапии данного заболевания или синдрома и индивидуального подбора фармакологических препаратов данному больному, призванных дополнить эмпиризм в фармакотерапии, а также совокупность методов контроля терапевтической эффективности и безопасности лекарств.
Её развитие во всём мире прошло ряд этапов, которые могут быть представлены следующим образом:
1960 — 1970 гг. проведение клинических испытаний, мониторинг нежелательных лекарственных реакций, изучение фармакокинетики.
1970 — 1980 гг. изучение взаимодействия лекарств, фармакогенетики, терапевтический мониторинг, улучшение методов оценки эффективности, совершенствование методологии исследований ЛС.
1980 — 1990 гг. фармакоэпидемиология, регистрация побочных эффектов, индивидуальное дозирование лекарств, информация о лекарственном препарате, контроль лекарственной терапии в клинике.
1990 — 2000 гг. молекулярная фармакогенетика, оценка дозирования лекарственных средств, фармакокинетическая оптимизация эффектов, доказательная фармакотерапия и фармакоэкономика.
По Вотчалу (основоположнику клинической фармакологии) – клиническая фармакология – наука о действии лекарств на больного человека; это фармакологическое мышление у постели больного. Лозунг клинической фармакологии: «Поменьше лекарств – только совершенно необходимые».
По очень точному выражению Б.Е. Вотчала, клиническая фармакология является «образом мышления врача» независимо от его специальности.
От экспериментальной фармакологии клиническая фармакология - отличается тем, что, основываясь на её данных, изучает действие тех или иных ЛС на больного человека, больше того – на данного больного. Клиническая фармакология отличается тем, что мышление идет не столько по линии нозологии, сколько по деталям патогенеза.
Клиническая фармакология тесно связана с другими областями медицины и биологии. Так, раскрытие этиологии и патогенеза многих заболеваний позволяет не только создать необходимый лекарственный препарат, но и разработать рациональные методы его применения. Благодаря успехам аналитической химии и разработке высокочувствительной аппаратуры стало возможным определение в тканях и жидкостях организма ничтожно малых концентраций лекарственных веществ, исследование их биотрансформации и выведения из организма.
В разных странах положение клинической фармакологии как науки неодинаково. В некоторых из них она выделена в отдельную дисциплину, а в системе здравоохранения работают специально подготовленные клинические фармакологи. В других — клиническая фармакология как наука не существует. Однако в настоящее время стало очевидно, что каждый врач независимо от специализации должен хорошо знать основы клинической фармакологии.
Основными разделами клинической фармакологии являються:
Ø фармакодинамика;
Ø фармакокинетика;
Ø фармакотоксикодинамика;
Ø методы контроля эффективности и безопасности ЛС;
Ø взаимодействие препаратов при их совместном применении;
Ø влияние пищи на фармакокинетику лекарственных средств и др.;
Ø изучение особенности действия лекарственных веществ в различных условиях (пожилой возраст, беременность и т.п.);
Ø фармакогенетика, предметом которой является определение генетических основ реакций организма на лекарственные вещества;
Ø методы клинического испытания лекарств.
Основные задачи клинической фармакологии:
| ¾ | ¾ клинические испытания новых фармакологических средств; |
| ¾ | ¾ клинические исследования и переоценка старых препаратов; |
| ¾ | ¾ совершенствование лекарственной терапии путем разработки рациональных методов эффективного и безопасного применения ЛС; |
| ¾ | ¾ организация информационных служб по лекарственным препаратам и консультационная помощь различным специалистам; |
| ¾ | ¾ обучение студентов и врачей – объединить фармакологию, патофизиологию и клинические дисциплины в единое целое – основная образовательная цель клинической фармакологии. |
На практике клинический фармаколог занимается решением следующих вопросов:
| ¾ | ¾ выбор ЛС для лечения конкретного больного; |
| ¾ | ¾ определение наиболее подходящих лекарственных форм и режима их применения; |
| ¾ | ¾ выбор пути введения препарата; |
| ¾ | ¾ мониторное наблюдение за действием ЛС; |
| ¾ | ¾ предупреждение и устранение побочных реакций и нежелательных последствий взаимодействия лекарственных веществ. |
¾ участие клинических фармакологов в работе экспертных органов, ответственных за испытание и применение лекарственных средств;
¾ исследование особенностей потребления лекарств – фармакоэпидемиология и фармакоэкономика.
Одной из наиболее важных задач клинической фармакологии является формирование у студентов и врачей клинического мышления в отношении использования ЛС для лечения конкретного больного с учетом, с одной стороны, множества факторов, характеризующих его состояние и индивидуальные особенности, а, с другой – свойств и особенностей ЛС.
Прежде чем назначить лечение, врач должен ответить себе на следующие вопросы.
Ø Каких конкретно изменений в состоянии больного он хочет добиться?
Ø Какие ЛС могут оказать желаемое действие?
Ø Какой препарат наиболее подходит данному больному?
Ø Каким образом применить препарат, чтобы действие его было наиболее эффективным?
Ø Какие побочные реакции может вызвать препарат, может ли он навредить больному?
Ø Каково соотношение возможных пользы и вреда при использовании ЛС?
В конечном итоге эффективность и безопасность фармакотерапии зависят от умения врача правильно оценить все эти факторы, которое должно основываться на глубоких знаниях как клинической медицины, так и экспериментальной фармакологии.
Лекарственное средство — фармакологическое средство, разрешенное уполномоченным на то органом соответствующей страны в установленном порядке для применения с целью лечения, предупреждения или диагностики заболевания у человека или животного. Для обозначения препаратов, еще не разрешенных к применению в качестве лекарственных препаратов, применяют термин “фармакологическое средство” — вещество с установленной фармакологической активностью, являющееся объектом клинических испытаний.
В настоящее время для обозначения лекарственных средств применяют два вида названий:
1) международные непатентованные названия, которые утверждаются официальными органами здравоохранения и используются в национальных и международных фармакопеях — сборниках стандартов и положений, нормирующих качество лекарственных средств;
2) торговые, или фирменные названия, которые являются коммерческой собственностью фармацевтической фирмы.
Один и тот же препарат, производимый различными фирмами, может иметь множество названий. Например, транквилизатор диазепам выпускается под названиями “валиум”, “седуксен”, “сибазон” и т.д. Некоторые лекарственные средства имеют более 100 торговых названий (например витамин В12). Обычно на упаковке лекарственного препарата приводится как фирменное, так и международное, непатентованное название.
ВИДЫ ФАРМАКОТЕРАПИИ
Этиотропная терапия направлена на устранение причины болезни, например, применение противомикробных средств при инфекционных заболеваниях или антидотов при отравлениях токсическими веществами.
Патогенетическая терапия направлена на устранение или подавление механизмов развития болезни. Большинство лекарственных препаратов оказывают именно патогенетическое действие — гипотензивное, антиаритмическое, противовоспалительное, психотропное и т.д.
Симптоматическая терапия направлена на устранение или уменьшение отдельных проявлений болезни. К симптоматическим средствам можно отнести обезболивающие препараты, не влияющие на причину или механизм развития болезни. Однако в некоторых случаях (например, при инфаркте миокарда) они могут существенно влиять на течение патологического процесса, по сути дела оказывая патогенетическое действие.
Заместительная терапия проводится при недостаточности естественных биологически активных веществ. К средствам заместительной терапии относят ферментные препараты, гормоны и их аналоги, витамины, которые, не устраняя причины заболевания, могут обеспечить нормальную жизнедеятельность организма в течение многих лет. Например, препараты инсулина.
Профилактическая терапия проводится для предупреждения заболеваний. К профилактическим средствам относят некоторые противовирусные, дезинфицирующие препараты.
ОСНОВНЫЕ ВОПРОСЫ ФАРМАКОКИНЕТИКИ
Фармакокинетика — раздел клинической фармакологии, предметом которого является изучение процессов всасывания, распределения, связывания с белками, биотрансформации и выведения лекарственных веществ. Ее развитие стало возможным благодаря разработке и внедрению в практику высокочувствительных методов определения содержания лекарственных веществ в биологических средах — газожидкостной хроматографии, радиоиммунных, ферментно-химических и других методов, а также благодаря разработке методов математического моделирования фармакокинетических процессов. На основании данных о фармакокинетике того или иного препарата определяют дозы, оптимальный путь введения, режим применения препарата и продолжительность лечения. Регулярный контроль содержания лекарственных средств в биологических жидкостях позволяет своевременно корригировать лечение.
Фармакокинетические исследования необходимы при разработке новых препаратов, их лекарственных форм, а также при экспериментальных и клинических испытаниях ЛС.
Процессы, происходящие с лекарственными препаратами в организме, могут быть описаны с помощью ряда параметров.
Одним из основных показателей, определяющих фармакологический эффект, считают концентрацию ЛС на уровне рецептора, однако в условиях целостного организма установить её невозможно. В эксперименте было доказано, что в большинстве случаев между концентрацией препарата в крови и его содержанием в области рецептора существует корреляция.
В связи с этим для определения фармакокинетических параметров изучают содержание ЛС в крови. Для того чтобы получить соответствующее представление о поступлении препарата в кровь и выведении его из организма, отслеживают изменения концентрации ЛС в плазме крови на протяжении длительного времени. Содержание препаратов в плазме крови определяют методами жидкостной или газожидкостной хроматографии, с помощью радиоиммунного или иммуноферментного анализа и другими способами.
На основании полученных данных строят график. На оси абсцисс отмечают время от начала исследования, а на оси ординат - концентрацию ЛС в плазме крови (в соответствующих единицах).
Такой график носит название фармакокинетической кривой (рис. 1).
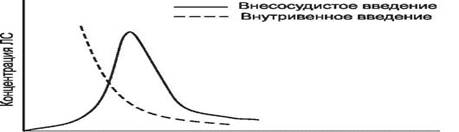 Время после введения
Время после введения
Концентрация лекарственного вещества (С) -это ее количество в определенном объеме крови в конкретный момент времени после введения в организм.
Константы скорости элиминации (Кel), абсорбции (Ка) и экскреции (Кex) – характеризуют соответственно скорость исчезновения препарата из организма путем биотрансформации и выведения, скорость поступления его из места введения в кровь и скорость выведения с мочой, калом, слюной и др.
Период полувыведения (Т1/2) — время, необходимое для уменьшения вдвое концентрации препарата в крови, зависит от константы скорости элиминации (Т1/2= 0,693/Кel).
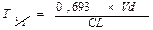
где Т1/2 – период полувыведения; 0,693 – коэффициент, который является логарифмом от 2; Vd - объем распределения; Сl - общий клиренс.
Константа элиминации (Кel) - процент уменьшения концентрации ЛВ в крови за единицу времени. Чем больше Кel, тем быстрее ЛВ выводится из крови. Константа элиминации зависит от периода полувыведения:
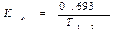
Период полуабсорбции (Т1/2а) - время, необходимое для всасывания половины дозы препарата из места введения в системный кровоток; пропорционален скорости абсорбции (Т1/2а = 0,693/Ка).
Константа абсорбции (Ка) - характеризует скорость всасывания ЛВ в организме человека или животного. Константа абсорбции зависит от периода полувыведения:
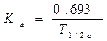
Распределение препарата в организме характеризуют период полураспределения, кажущаяся начальная и стационарная (равновесная) концентрации, объем распределения.
Период полураспределения (Т1/2,a) — время, необходимое для достижения концентрации препарата в крови, равной 50% от равновесной, т.е. при наличии равновесия между кровью и тканями.
Кажущаяся начальная концентрация (С0) — концентрация препарата, которая была бы достигнута в плазме крови при внутривенном его введении и мгновенном распределении по органам и тканям.
Равновесная концентрация (Сss) — концентрация препарата, которая установится в плазме (сыворотке) крови при поступлении препарата в организм с постоянной скоростью. При прерывистом введении (приеме) препарата через одинаковые промежутки времени в одинаковых дозах выделяют максимальную (Сssmax) и минимальную (Сssmin) равновесные концентрации.
Объем распределения препарата (Vd - volume of distribution)характеризует степень его захвата тканями из плазмы (сыворотки) крови. Vd (Vd= D/C0) — условный объем жидкости, в котором нужно растворить всю попавшую в организм дозу препарата (D), чтобы получилась концентрация, равная кажущейся начальной концентрации в сыворотке крови (С0).
Общий клиренс препарата (Clt) характеризует скорость “очищения” организма от лекарственного препарата.
 где Сl – общий клиренс; D – доза введенного препарата; AUC – площадь под фармакокинетической кривой.Выделяют почечный (Clr) и внепочечный (Cler) клиренсы, которые отражают выведение лекарственного вещества соответственно с мочой и другими путями (прежде всего с желчью). Общий клиренс является суммой почечного и внепочечного клиренса.
где Сl – общий клиренс; D – доза введенного препарата; AUC – площадь под фармакокинетической кривой.Выделяют почечный (Clr) и внепочечный (Cler) клиренсы, которые отражают выведение лекарственного вещества соответственно с мочой и другими путями (прежде всего с желчью). Общий клиренс является суммой почечного и внепочечного клиренса. 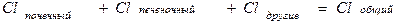
Площадь под кривой “концентрация — время” (AUC - area under the curve)— площадь фигуры, ограниченной фармакокинетической кривой и осями координат (AUC = C0/Kel). Величина (AUC) связана с другими фармакокинетическими параметрами — объемом распределения, общим клиренсом. При линейности кинетики препарата в организме величина AUC пропорциональна общему количеству (дозе) препарата, попавшего в системный кровоток. Часто определяют площадь под частью кривой (от нуля до некоторого времени t); этот параметр обозначают AUCt, например, площадь под кривой от 0 до 8 ч — AUC8.
Абсолютная биодоступность (f) — часть дозы препарата (в %), которая достигла системного кровотока после внесосудистого введения, равна отношению AUC после введения исследуемым методом (внутрь, в мышцу и др.) к AUC после внутривенного введения. Относительную биодоступность определяют для сравнения биодоступности двух лекарственных форм для внесосудистого введения. Она равна отношению (AUC’/AUC)(D/D’) после введения двух сравниваемых форм. Общая биодоступность — часть принятой внутрь дозы препарата, которая достигла системного кровотока в неизмененном виде и в виде метаболитов, образовавшихся в процессе всасывания в результате так называемого пресистемного метаболизма, или “эффекта первичного прохождения”.
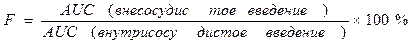
Биоэквивалентность (сравнительная биодоступность) - это соотношение количества ЛВ, поступающего в кровь при введении его в различных лекарственных формах (или ЛС разных фирм). Если лекарственные препараты демонстрируют схожую биодоступность, они расцениваются как биоэквивалентны.
ВСАСЫВАНИЕ — процесс поступления лекарственного вещества из места введения в кровь. Существуют четыре механизма всасывания ЛС при энтеральном введении (рис. 2):
Ø пассивная диффузия;
Ø активный транспорт;
Ø фильтрация через поры;
Ø пиноцитоз
Прохождение большинства лекарственных препаратов через слизистую оболочку пищеварительного тракта определяется их растворимостью в липидах и ионизацией. При приеме лекарственных веществ внутрь скорость их абсорбции отличается в различных отделах ЖКТ.
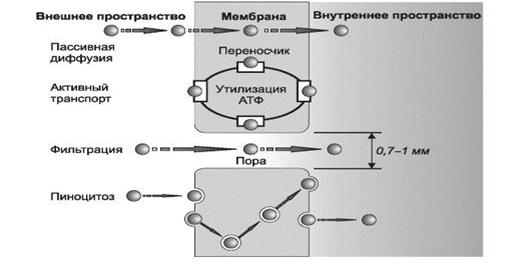
Q - молекула лекарственного вещества
После прохождения через стенку желудка и/или кишечника лекарственный препарат поступает в печень. Некоторые лекарственные вещества под влиянием ферментов печени подвергаются значительным изменениям (“эффект первичного прохождения”). Именно поэтому, а не вследствие плохой абсорбции, для достижения достаточного эффекта дозы некоторых препаратов (пропранолола, аминазина, опиатов) при приеме их внутрь должны быть значительно больше, чем при внутривенном введении. Биотрансформацию вещества при первичном прохождении через печень в процессе всасывания называют пресистемным метаболизмом. Интенсивность пресистемного метаболизма зависит от скорости тока крови в печени.
На процесс всасывания лекарств в желудке и кишечнике оказывает влияние рН, который в желудке равен 1-3, в двенадцатиперстной кишке — 5-6, а в тонкой и толстой кишках — около 8. Кислоты легче всасываются в желудке, а основания — в тонкой или толстой кишке.
Под действием кислой среды желудка некоторые лекарственные средства, в частности бензилпенициллин, могут разрушаться.
На лекарственные препараты оказывают также действие ферменты желудочно-кишечного тракта, которые способны инактивировать белки и полипептиды (АКТГ, вазопрессин, инсулин и т.д.), а также некоторые другие вещества (прогестерон, тестостерон, альдостерон). Соли желчных кислот в свою очередь могут ускорить всасывание лекарственных средств или замедлить его при образовании нерастворимых соединений.
На всасывание лекарственных веществ влияют также моторика желудочно-кишечного тракта, объем и состав пищи, количество принимаемой жидкости, интервал времени между едой и приемом препаратов. Так, молоко нарушает всасывание тетрациклинов, ампициллина и амоксициллина. Следует учитывать и стимулирующее действие пищи на секрецию желудочного сока и соляной кислоты.
Для переноса веществ в ЖКТ особое значение имеют большая площадь поверхности кишечника и влияние постоянного кровотока в слизистой оболочке на градиенты концентрации между просветом кишечника и кровью. Путем диффузии и осмоса через слизистую оболочку кишечника переносятся, в частности, вода, С1 ¯, а также такие вещества, как аскорбиновая кислота, пиридоксин и рибофлавин. Поскольку клеточные мембраны содержат большое количество липидов, для диффузии через мембрану вещества должны быть в некоторой степени жирорастворимыми. Согласно теории неионной диффузии, указанным путем переносятся главным образом недиссоциированные соли слабых кислот или слабых оснований. Это необходимо учитывать при назначении лекарств, большая часть которых всасывается путем диффузии. Для переноса какого-либо вещества в соответствии с уравнением Гендерсона-Гассельбаха особое значение имеет рКа этого вещества и рН в просвете кишечника:
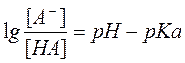 ,
, 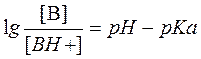 , где
, где
[А¯], [ВН+] – молярные концентрации ионизированных,
[НА], [В] – неионизированных форм кислоты НА и основы В;
рН – кислотно-основной показатель среды;
рКа – логарифм константы диссоциации соединения, количественно равный значению рН, при котором анализируемое соединение диссоциирует наполовину.
Из уравнения видно, что с увеличением значения рН среды диссоциация кислот увеличивается, а оснований - уменьшается.
Таким образом, факторы, влияющие на процессы всасывания ЛВ, разнообразны: растворимость вещества в липидах, степень ионизации молекулы (чем меньше ионизированная молекула, тем лучше она всасывается), перистальтика кишечника, характер и количество пищевой массы, особенности регионарного кровотока, состояние соединительной ткани, агрегантное состояние веществ, сочетание лекарственных средств.
Дата добавления: 2015-03-03; просмотров: 930;
