Лекція 4. Антитіла, їх будова і властивості.
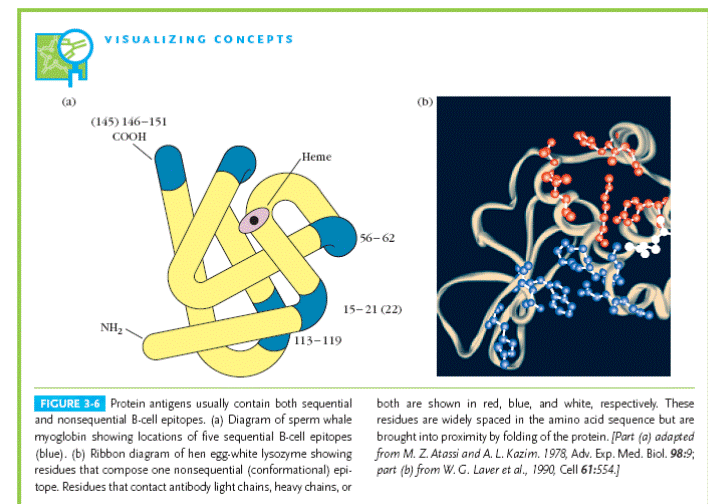
Імунна система здатна впізнати майже будь-яку речовину із середовища, що оточує макроорганізм. Для цього антиген має бути належним чином представлений імунним клітинам. В лімфоцити і антитіла розпізнають конформаційно-залежні поверхневі епітопи, розташовані у місцях найбільшої гідрофільності та гнучкості поліпептидного ланцюга. Т лімфоцити розпізнають внутрішні лінійні пептидні фрагменти, які утворюються в результаті протеолізу (процесингу) нативного антигену.
 | |||
 |
Лекція 4. Антитіла, їх будова і властивості.
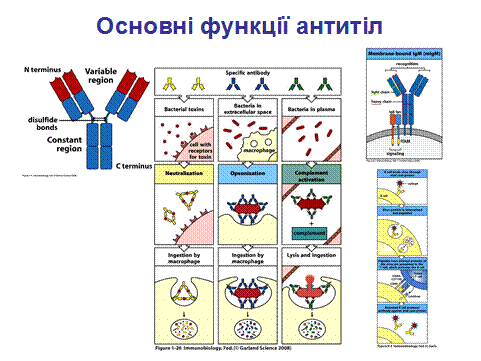
Антитіла виконують ряд функцій, спрямованих на елімінацію АГ, як то: розпізнають і зв’язують АГ, допомагають у його презентації макрофагам і лімфоцитам, зумовлюють ушкодження мастоцитів, активують систему комплементу і т. д.
Але основними на сьогодні є 3 функції. Перший і власне прямий шлях, за яким антитіла можуть працювати в системі захисту проти патогенів та їх продуктів - це зв’язування останніх і таким чином блокування їх доступу до клітин, які вони можуть інфікувати чи зруйнувати (ліва панель на рис.1.26). Цей процес отримав назву нейтралізація (1 функція) , є важливим в антивірусному захисті, попереджаючи проникнення вірусів у клітину і їх подальшу реплікацію, а також відіграє певну роль в захисті проти бактеріальних токсинів. Незв’язані токсини можуть реагувати з рецепторами на клітині – хазяїні, в той час як комплекс токсин-антитіло не має можливості утворити такий зв’язок. На останньому етапі комплекс антиген – антитіло кінець кінцем видаляється і деградує з залученням системи макрофагів.
Ряд бактерій ухиляються від системи природного імунітету, тому що можуть мати таку характерну зовнішню оболонку (S-білковий шар+клітинна стінка+ бактеріальна цитоплазматична мембрана), яка не розпізнається образ – розпізнаючими (pattern recognition receptors) рецепторами фагоцитів. Однак антигени оболонки можуть розпізнаватись антитілами, а фагоцити, в свою чергу, містять рецептори, які зв’язують ці антитіла, що потім приводить до руйнації бактеріальної клітини шляхом фагоцитозу (середня панель на рис. 1.26). Прикріплення антитіл до поверхні патогенів чи чужорідних часточок з подальшою їх елімінацією отримало назву опсонізація (2 функція).
І третя функція антитіл – активація комплементу. Комплемент в першу чергу є частиною системи природного імунітету, хоча на правій панелі рис.1.26 - активація системи комплементу за класичним шляхом, при якій відбувається зв'язування імунних комплексів [АГ-АТ] з ферментним комплексом С1 системи комплементу, що фактично поєднує систему природного (комплемент) і набутого (антитіла).
Тому і назва « комплемент» походить від підсилення (доповнення) =complement активності антитіл.
До функцій антитіл як частини В-клітинного рецептора належать: а) пряма активація В-клітин при взаємодії з деякими бактеріальними антигенами, б) представлення антигенів в комплексі з молекулами МНС II системі Т-клітинного імунітету. (Рис. 6.9; 9.4).
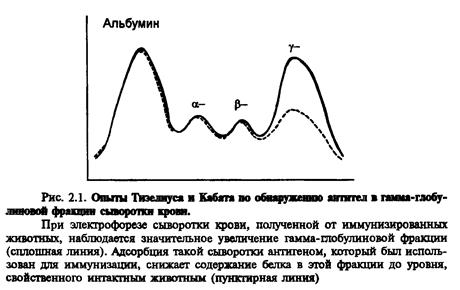
Природу антитіл було визначено тільки в середині XX століття. У 1937-1939 році Ян Тізеліус і Кабот провeли електрофорез білків сироватки крові та визначили, що вони поділяються на альбуміни та альфа1-, альфа2-, бета- та гамма - глобуліни. Гамма - глобуліни виявились найменш рухливими в електричному полі і залишались майже на старті. Після імунізації тварини зростав пік гамма-глобулінів в її сироватці, а після виснаження імунної сироватки антигеном він знову знижувався до рівня інтактних тварин (рис.). Отже, антитіла - це гамма - глобуліни. Щоб підкреслити роль антитіл в імунних реакціях, їх стали називати імуноглобулінами.
 |
Перші ж дані, що характеризували антитіла, було представлено в роботах Еміля фон Беринга і Кітазато, які в 1890 р. продемонстрували, що сироватка від мишей, які попередньо були імунізовані токсином правцю, при введенні інтактним тваринам захищає останніх від загибелі при дії смертельної дози токсину. Таким чином, утворений в результаті імунізації сироватковий фактор –антитоксин, - був першим відкритим вченими антитілом.
Вивченню структури антитіл сприяло використання так званих мієломних імуноглобулінів. Було встановлено, що у хворих з пухлинами лімфатичної системи (мієломи- злоякісні захворювання, при яких вибірково розмножуються В лімфоцити однієї специфічності, утворюючи клон, приклад: пухлина кісткового мозку- множинна мієлома) накопичується велика кількість абсолютно однакових моноклональних антитіл (до 70 мг/мл сироватки) чи їх фрагментів. Так, білки Бенс - Джонса, які секретуються у сечу хворих на множинну мієлому- це легкі ланцюги імуноглобулінів.
В 1972 році Едельман і Портер отримали Нобелівську премію за вивчення структури антитіл.
Сьогодні можна дати таке визначення антитіла (імуноглобуліну ) - це продуковані В-лімфоцитами глікопротеїни гамма-глобулінової фракції плазми крові вищих тварин і людини, які здатні специфічно взаємодіяти з антигеном.
Нагадаю, що структурна організація білків (за Шульцем Г., Ширмером Р.) складається з 6 рівнів.
Первинна структура – пептидний зв’язок.
Вторинна структура- 1- α-спіраль; β - структура; 2- водневі зв'язки.
Супер(над)вторинна - “цинковий палець” = Zinc Finger Motifs; спіраль-поворот-спіраль; “Лейцинова застібка” = Leucine Zipper і т.д.
Доменна організація – виокремлені функційні області (часто це - ділянка поліпептидного ланцюга, яка в процесі формування просторової структури незалежно від інших частин ланцюга, набула глобулярної конформації).
Третинна структура - водневі, іонні, гідрофобні, ковалентні (дисульфідні) та Ван-дер-Ваальсові взаємодії.
Четвертинна структура. Є ряд білків, до складу яких входять 2 та більше поліпептидних ланцюга, що після формування їх третинної структури можуть об’єднуватись з залученням гідрофобних, іонних та водневих зв’язків. Окремі поліпептидні ланцюги в цих білках - протомери, чи субодиниці, а їх взаємне розташування в просторі - четвертинна структура білка. Таким чином до складу олігомерного білка входять декілька протомерів.
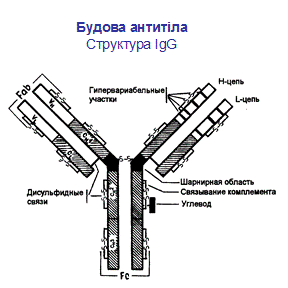
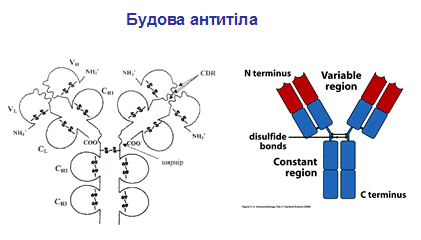
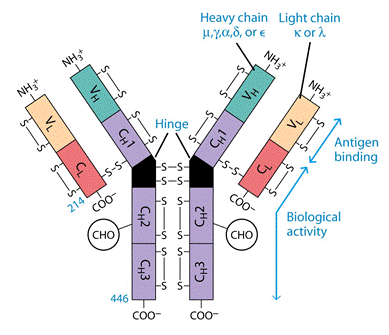
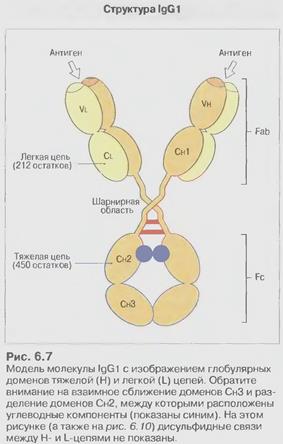
Молекула антитіла складається із двох типів поліпептидних ланцюгів: важких (Н) і легких (L) (слайд 6). Первинна структура- важкий ланцюг складається із 440-450 амінокислотних залишків (μ –ланцюг та ε мають на 100 залишків більше) і має молекулярну масу близько 50 кДа, а легкий ланцюг складається із 220-230 амінокислотних залишків і має молекулярну масу близько 25 кДа.
 Вторинна структура імуноглобулінів - переважно антипаралельна β -складка, спіралізованих ділянок майже немає (слайд 7). Доменна організація - гнучкість фрагментів відносно осі молекули та специфічна будова центру, що зв'язує антиген (слайд 8). У третинній структурі - типовий рівень організації. Четвертинна структура -антитіла – білки, до складу яких входять 4 поліпептидні ланцюги, 2 з яких є ідентичними важкими (Н), 2 – ідентичними легкими (L) ланцюгами. Ланцюги з'єднані між собою міжланцюговими дисульфідними зв'язками (Н-Н та Н- L). (Слайд 6,7,8,9).
Вторинна структура імуноглобулінів - переважно антипаралельна β -складка, спіралізованих ділянок майже немає (слайд 7). Доменна організація - гнучкість фрагментів відносно осі молекули та специфічна будова центру, що зв'язує антиген (слайд 8). У третинній структурі - типовий рівень організації. Четвертинна структура -антитіла – білки, до складу яких входять 4 поліпептидні ланцюги, 2 з яких є ідентичними важкими (Н), 2 – ідентичними легкими (L) ланцюгами. Ланцюги з'єднані між собою міжланцюговими дисульфідними зв'язками (Н-Н та Н- L). (Слайд 6,7,8,9).
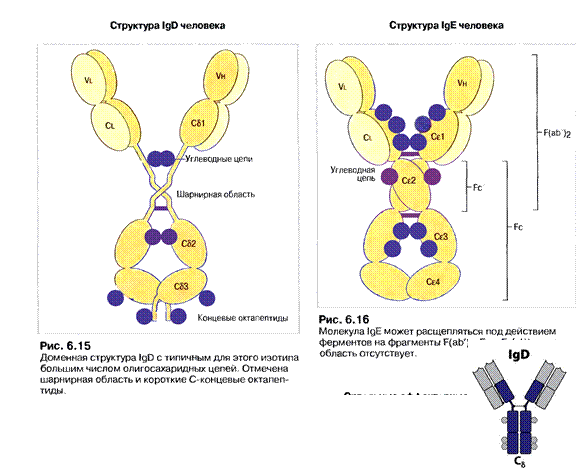
Важкі ланцюги поділяють на класи: α, μ, γ, δ, ε, - і відповідно розрізняють п'ять класів (ізотипів) імуноглобулінів: ІgА, ІgМ, ІgG, ІgD, ІgЕ. Для легких ланцюгів виділяють типи k і λ; k зустрічаються частіше, ніж λ. У структурі молекули імуноглобуліну міститься два важких і легких ланцюга. Підкласи важких ланцюгів (у людини): 4γ (γ1, γ2, γЗ і γ4), 2μ (μ1 і μ2), 2α (α1 і α2), 1ε і 1δ. Підтипи легких ланцюгів: 1κ, 4λ (+λ5, що експресується в ембріональному стані). (Табл.1).
Табл. 1. Будова молекули антитіла

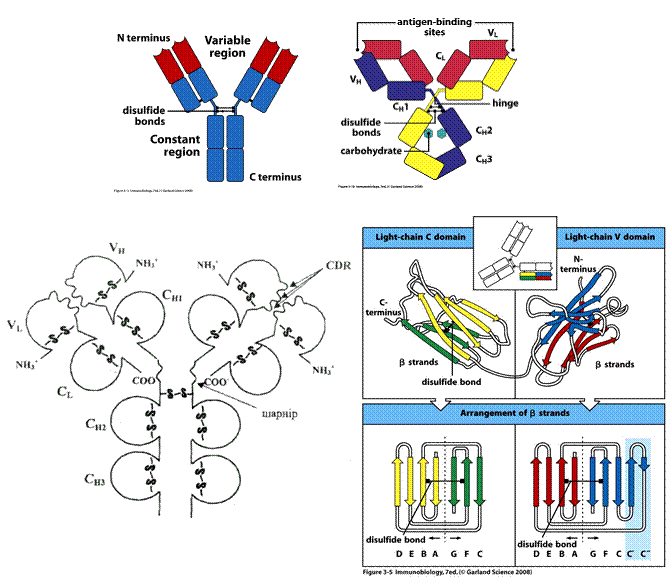
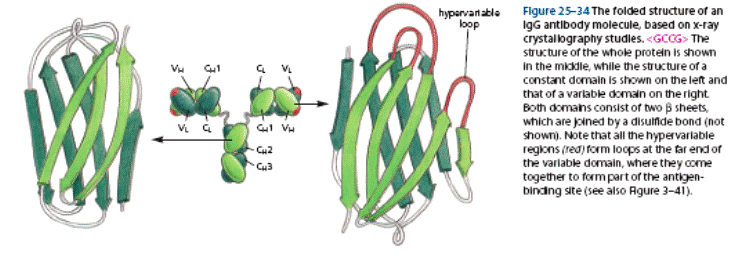
Імуноглобуліни характеризується вираженою доменністю, що структурується внутрішньоланцюговими дисульфідними зв'язками. Саме вони замикають домени (приблизно по 60-70 амінокислотних залишків), їх два у легкому ланцюгу і чотири у важкому (п'ять у ε- та μ-ланцюгу). Справа і зліва знаходяться приблизно по 20 а.з., які не входять в структуру домену, а слугують для з'єднання з сусідніми доменами.До складу доменів входять 2 β шари, які містять атипаралельні 3-х та 4-х сегменті β-складки, що структуровані дисульфідними містками (вторинна структура). Фактично утворюється структура, що нагадує діжку.
Рис.2. Принцип доменної організації іммуноглобулінів
 | |||||||||
 | |||||||||
 | |||||||||
 | |||||||||
 |
Типова молекула імуноглобуліну. Виділено структурну організацію легкого ланцюга імуноглобуліну
Домени такої будови зустрічаються у багатьох рецепторних молекулах; їх так і називають - імуноглобуліноподібні домени..
Рис. Надродина імуноглобуліноподібних молекул, яка нараховує у людини приблизно 765 членів 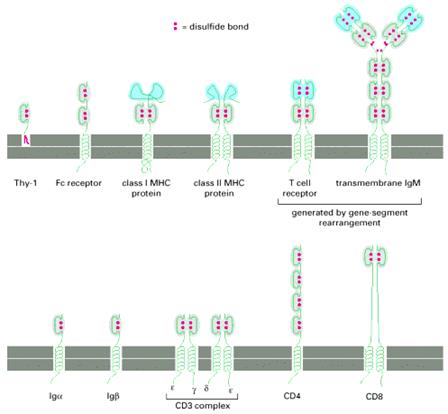

Імуноглобуліни - глікопротеїни, містять до 12% вуглеводів ( IgG - 2-3%), а саме манозу та галактозу,сіалову кислоту,які ковалентно включаються у пептидний ланцюг в районі СH2 домену через глікозидний зв'язок між аспарагіном і N-ацетилглюкозаміном. Ці компоненти приєднуються до молекули імуноглобуліну в процесі біосинтезу ланцюгів і в момент проходження через комплекс Гольджі. Вуглеводи підтримують функціональну конформацію доменів, захищають чутливі ділянки від пошкоджень протеолітичними ферментами і, можливо, беруть участь у транспортуванні і секреції імуноглобулінів.
Рис 4. Вуглеводні компоненти імуноглобулінів.
Олігоцукор (N-aцетилглюкозамін, манноза,галактоза), що зв’язаний N-глікозидним зв’язком з залишком аспарагіну у Fc фрагменті Ig G.
 |
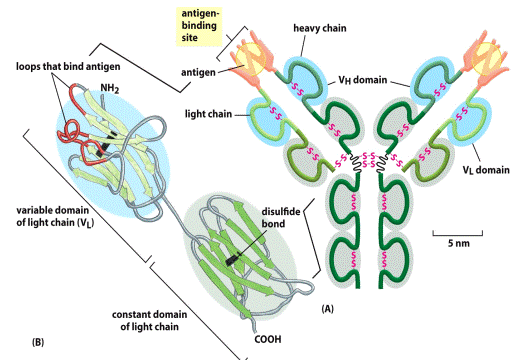
При порівнянні амінокислотних послідовностей десятків мієломних білків було помічено, що найбільш змінні за амінокислотними залишками ділянки імуноглобулінів локалізовано у перших (N-кінцевих) доменах важкого і легкого ланцюгів. Саме вони отримали назву варіабільні (V-variable) домени. Відповідно, стали розрізняти константні домени з більш сталим амінокислотним складом (С-constant ). Так, легкий ланцюг складено із одного V і одного С доменів, а важкий - із одного V і трьох ( μ- та ε -ланцюги із чотирьох) С доменів. Їх позначають відповідно VL,VH, CL i СH. З одним набором С-доменів може бути об'єднано багато V-доменів. Клас імуноглобулінів визначається саме С доменом, тобто один V-домен може бути в складі як ІgМ, так і IgА, а імуноглобуліни одного класу можуть мати широкий спектр V-доменів (слайд).
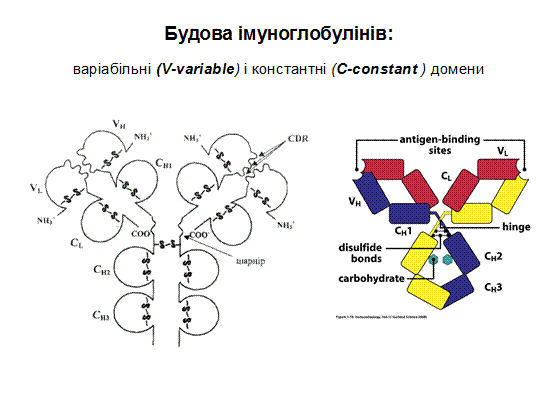


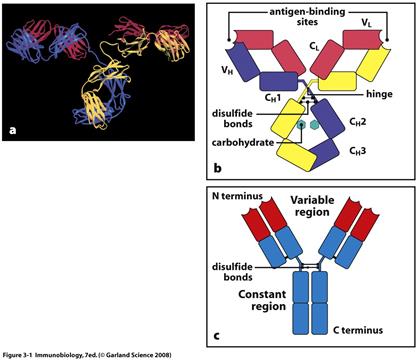
У складі V-доменів виділяють так звані гіперваріабільні ділянки, де заміни амінокислот зустрічаються частіше за інші. Їх ще називають СDRs (complementarity determining regions), тобто ділянки, що визначають комплементарність зв'язування з антигеном (гарячі точки антитіл). Саме ці ділянки входять до складу активного центру антитіла. Їх по три у важкому і легкому ланцюгах (CDR1, CDR2, CDR3). Ділянки між ними – каркасні (регіони зрізу - frame region= FR)- їх 4, саме вони визначають взаємне розташування СDRs. Структурно СDRs випетльовуються з β-складок, утворених каркасними ділянками. Завдяки симетричній структурі імуноглобуліну кожна молекула антитіла має два центри зв'язування з антигеном: між V-доменами важких і легких ланцюгів кожної пари, а саме між скомпонованими СDRs обох ланцюгів.
Четвертинний рівень організації імуноглобулінів
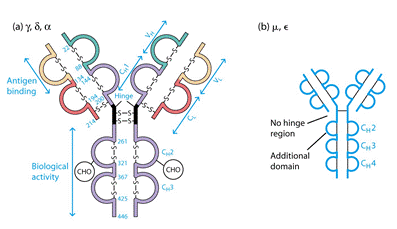
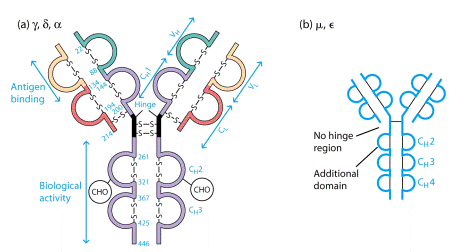
Два однакових Н- ланцюга орієнтовані в молекулі так, що їх С-кінці зближені і ланцюги закручені один відносно іншого ділянками, які містять домени Сн2, Сн3 і якщо є –Сн4. Між доменами існують як слабкі зв’язки, так і класичні ковалентні (S-S), що забезпечують фіксацію цих ділянок одна відносно іншої. Кількість S-S зв’язків і їх положення варіює залежно від класу і підкласу імуноглобуліну, але більшість з них розташована в районі других константних доменів.
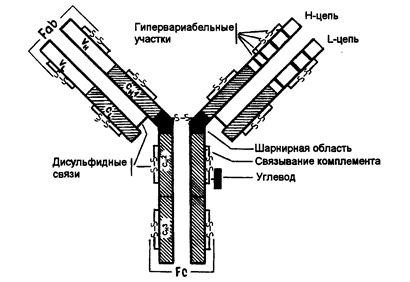 В трьох з п´яти Н-ланцюгів, а саме γ, δ, α, між Сн1та Сн2 доменами є багата на залишки проліну та цистеїну шарнірна ділянка, Hinge region, яка забезпечує рухомість "верхніх" частин молекули, що складаються з Сн1 і V доменів.
В трьох з п´яти Н-ланцюгів, а саме γ, δ, α, між Сн1та Сн2 доменами є багата на залишки проліну та цистеїну шарнірна ділянка, Hinge region, яка забезпечує рухомість "верхніх" частин молекули, що складаються з Сн1 і V доменів.
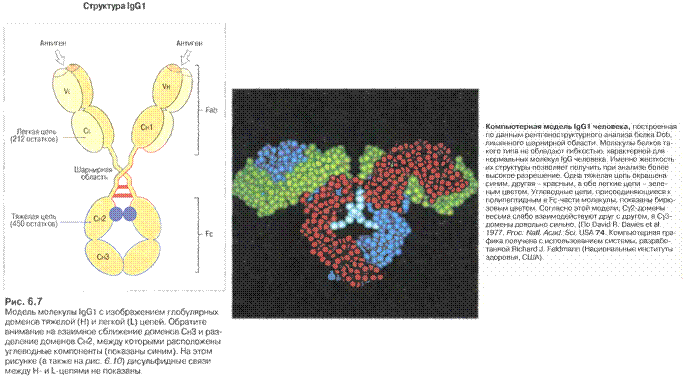
Рис.7.1. Будова антитіла . Структура IgG
 | |||
 |
В районі шарнірних ділянок фактично приєднуються ідентичні один одному легкі ланцюги, чиї N-кінці є тісно зближеними з N-кінцями важких ланцюгів, а С-кінець легкого ланцюга поєднаний з важким ланцюгом в районі Сн1 домена. Легкий ланцюг є жорстко фіксованим відносно важкого за рахунок слабких взаємодій, а також як мін 1 ковалентного S-S зв’язка між Сн1 і CL доменом. Єдиним виключенням є IgА2, який не містить такого міжланцюгового дисульфідного зв’язку. Отже рухомими є Сн1 і V домени легких і важких ланцюгів, що забезпечує умови для кращого зв’язування АГ.
Рис.7.2. Будова антитіла . Структура IgG1
 | |||
 |
Протеолітична фрагментація імуноглобулінів.
В 50-60 р.р. ХХ ст. співробітниками лабораторій Едельмана і Портера було проведено ряд блискучих досліджень, що дали можливість свівставити структуру і функції молекул імуноглобулінів. Шляхом протеолізу можна отримати фрагменти імуноглобулінів, частина з яких зберігає здатність зв'язуватися з антигеном (Рис. ). Найбільш чутливою до протеолізу є шарнірна ділянка (регіон завіс) завдяки наявності великої кількості залишків цистеїну та проліну, що, як зазначено, забезпечують гнучкість поліпептидних ланцюгів і доступність до дії протеолітичних ферментів. Отже зміна кута між двома "ручками", що містять центри зв'язування антигену, відбувається завдяки гнучкості шарнірної ділянки молекула імуноглобуліну і сприяє кращому зв’язуванню з молекулою АГ.
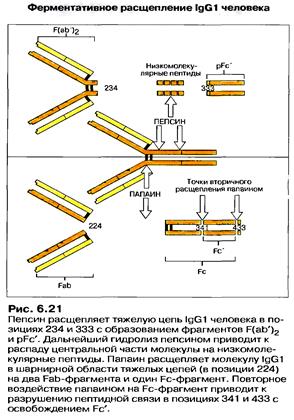
Папаїн розщеплює молекулу імуноглобуліну вище шарнірної ділянки на 2Fab (Fragment antigen-binding) + Fc (Fragment cristallizable, constant) фрагменти. Fаb (по 50 кДа) зберігають властивість зв'язуватися з антигеном, оскільки містять варіабільні домени важкого та легкого ланцюгів, і є моновалентними. Fc (50 кДа) не зв'язує антиген і несе властивості, характерні для даного класу імуноглобулінів. За допомогою плазміну Fab фрагмент може бути далі розщеплений на Fv і Fd фрагменти, по 25 кДа кожний.
Пепсин розщеплює молекулу імуноглобуліну нижче шарнірної ділянки, в результаті чого утворюється двохвалентний F(ab’)2 і рFс’ фрагменти із М.М. 100 і 50 кДа, відповідно. Шляхом відновлення дисульфідних зв'язків (наприклад, за допомогою 2-меркаптоетанолу) молекулу імуноглобуліну можна розібрати спочатку на дві половинки по 75 кДа, а потім - на важкі та легкі ланцюги. Половинки повністю, а важкі ланцюги частково, зберігають здатність зв'язуватись з антигеном. (Рис.8.1; 8.2).
Рис.8.1. Протеолітична фрагментація імуноглобулінів.
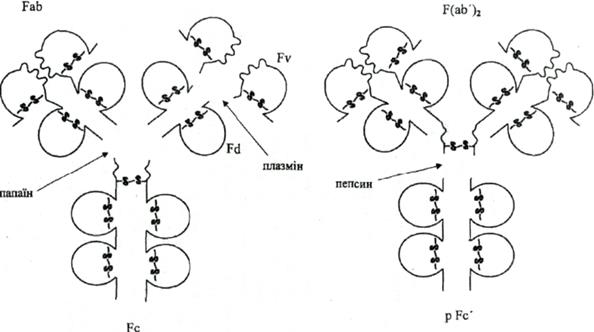 |
Рис.8.2. Протеолітична фрагментація імуноглобулінів.
 |
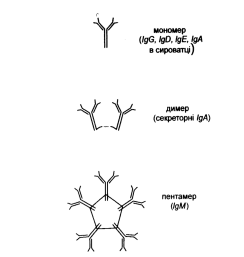
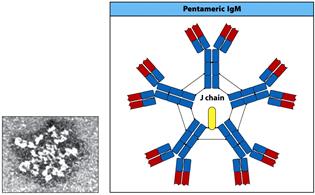
Деякі класи імуноглобулінів утворюють олігомерні форми. Так, ІgА утворюють димери, а ІgМ - пентамери. Пентамер утворюється за рахунок дисульфідних зв'язків між окремими молекулами ІgМ, крім того додається J-ланцюг (12 кДа), який циклізує весь олігомер у вигляді зірки. IgG, ІgD, ІgЕ зустрічаються тільки у вигляді мономерів (150 кДа) , а пентамеру ІgМ- 890-900 кДа.
Рис. 9. Мономерна і полімерні форми імуноглобулінів.
 |
Імуноглобуліни теж можна розглядати як антигени. На них відрізняють чотири типи антигенних детермінант: видові, алотипічні, ізотипічні та ідіотипічні.
Видові-характерні для імуноглобулінів всіх особин певного виду. Вони визначаються будовою важкого і легкого ланцюгів. За цими детермінантами можна визначити видову приналежність антитіл.
Алотипічні детермінанти обумовлені існуванням алельних форм (алельних генів одного локусу) імуноглобулінів і притаманні генетично різним особинам одного виду, що дає можливість їх розрізняти. У білковій структурі вони визначаються як заміни 2-3 амінокислотних залишків і розташовані на легкому і важкому ланцюгу імуноглобулінів.
Ізотипічні антигенні детермінанти локалізовані на Fс фрагментах важких ланцюгів і фактично є характеристиками 5 ізотипів (класів) і підкласів важких ланцюгів.
Ідіотипічні детермінанти відображають особливості будови антигензв'язуючого центру молекули імуноглобуліна і позв'язані з V-доменами легкого і важкого ланцюга, а саме з Fаb -фрагментами антитіл. Фактично, ідіотип визначає специфічність антитіла, він є індивідуальним для кожної молекули і до його складу входять амінокислотні залишки гіперваріабільних ділянок (CDR).
Ізо-, ало- та ідіотип-специфічні антитіла можна отримати штучно і використовувати для ідентифікації відповідних детермінант на молекулі імуноглобуліну.
Молекулу імуноглобуліну побудовано таким чином, що різні її ділянки відповідають за різні функції. Так, функцією Fаb-фрагменту є утворення центру, що зв'язує антиген. Біологічний ефект зв'язування антигену, тобто наслідок його імунного розпізнання, залежить від природи Fс-фрагменту. Це можуть бути зв'язування з Fс-рецепторами, які існують на поверхні багатьох клітин, фіксація комплементу та деякі інші, так звані ефекторні функції. Різні класи імуноглобулінів мають різні структури Fс- фрагментів і, відповідно, можуть виконувати різні функції.
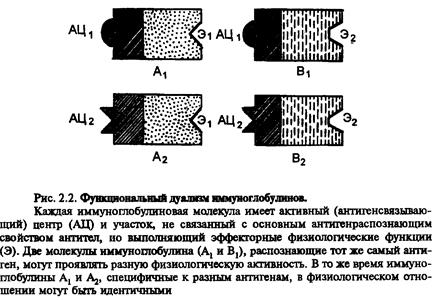 Отже, аналізуючи структуру і функції Іg треба відрізняти 2 поняття- гетерогенність і варіабельність. Гетерогенність визначає властивості Іg, що зумовлені константною частиною молекули, що вирізрізняє роботу різних класів цих молекул. Варіабельність – це індивідуальна характеристика Іg, що належать до одного класу або підкласу. Виявляється у специфічній антигензвязуючій активності і характеризується варіабельними доменами молекул антитіл.
Отже, аналізуючи структуру і функції Іg треба відрізняти 2 поняття- гетерогенність і варіабельність. Гетерогенність визначає властивості Іg, що зумовлені константною частиною молекули, що вирізрізняє роботу різних класів цих молекул. Варіабельність – це індивідуальна характеристика Іg, що належать до одного класу або підкласу. Виявляється у специфічній антигензвязуючій активності і характеризується варіабельними доменами молекул антитіл.
 Коротка характеристика різних класів
Коротка характеристика різних класів
імуноглобулінів
ІgМ ( 5-10% сироваткових Іg )
Антитіла цього класу синтезуються на початковій стадії імунної відповіді і першими з'являються в онтогенезі. На мембрані В клітин ІgМ знаходиться у вигляді мономеру із додатковим гідрофобним доменом. В цьому імуноглобуліні також міститься додатковий Сн4 домен та відсутня шарнірна ділянка, роль якої виконує другий константний домен (Сн2-домен). ІgМ містять вуглеводні залишки в доменах Сн1, Сн2, Сн3 і хвостові ділянки на С-кінці, що нараховують до 18 амінокислотних залишків.
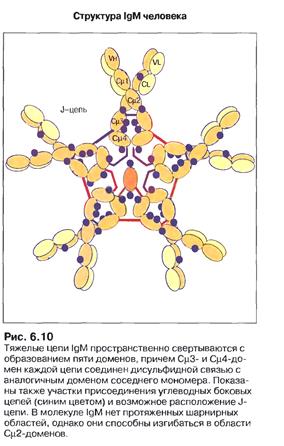
Завдяки наявності J-joint (єднального) - ланцюга, що є поліпептидом
(137 а.з., 12 кДа) та з'єднується дисульфідними зв’язками з хвостовими ділянками ІgМ, утворюється досить жорстка пентамерна структура цього імуноглобуліну. Після активації В лімфоцити спочатку секретують пентамерний ІgМ, а потім переключаються на ІgG або інші класи імуноглобулінів. Таким чином ІgМ є першим бар'єром на шляху інфекції. Він має невисоку специфічність (спорідненість) до антигену, але завдяки своїй пентамерній формі може одночасно зв'язати п'ять молекул антигену, що в сумі дає високу авідність зв'язування.
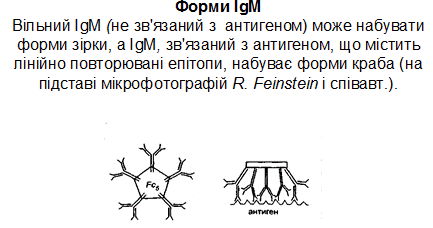
Вільний, не зв’язаний з антигеном пентамерний ІgМ, може мати форму зірки (сніжинки), в той час як зв’язаний з антигеном, що має лінійно повторювані епітопи, форму краба. Ця форма утворюється в основному після закріплення на поверхні чужерідної клітини, що сприяє відкриванню на Сн3-домені сайтів зв’язування з білками системи комплементу, запускаючи роботу останнього по класичному шляху.
Також завдяки олігомерності ІgМ легко викликає аглютинацію(злипання) мікробіальних клітин, що сприяє їх знищенню макрофагами. Так звані "нормальні" антитіла, присутні в крові здорових індивідів, теж є здебільшого ІgМ. Наявність у сироватці високої концентрації мономерних форм ІgМ свідчить про можливість таким захворювань як ревматоїдний артрит і т.д.
Еволюційно цей клас з'явився раніше, ніж інші класи імуноглобулінів. Але недоліком пентамерних комплексів є їх низька мобільність (900 кДа). Тому ссавці "перейшли" на ІgG для зв’язування чужорідних агентів у внутрішньому середовищі, а ІgА- в слизових.
 | |||||
 | |||||
 |
 ІgG (70-80% сироваткових Іg)
ІgG (70-80% сироваткових Іg)
Це головний клас сироваткових антитіл при вторинній імунній відповіді, є основними молекулами гуморального імунітету. При первинній імунній відповіді на 10 добу заміняють ІgМ, які утворилися першими. Маючи найменшу з усіх Іg молекулярну масу- 150 кДа, можуть долати всі бар’єри тобто є "вездесущими".
Проходять крізь плаценту, тому у перші тижні життя ІgG матері є головним засобом захисту новонародженого від інфекцій. Містяться також у молозиві. Клітини плаценти, що "торкаються" материнської крові, містять специфічні Fс-рецептори, які зв’язують молекули ІgG, що і забезпечує їх перехід в кровоносну систему плоду. Антитіла спочатку поглинаються шляхом ендоцитозу за участі рецепторів, потім транспортуються в пухирцях через клітини і виводяться шляхом екзоцитозу у кров плоду (шлях трансцитозу). Інші антитіла не зв’язуються з цими рецепторами, тому і не можуть проходити крізь плаценту.
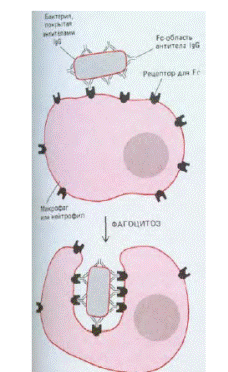
ІgG мають велике значення для опсонізації бактеріальних токсинів і мікроорганізмів. Нагадаю, опсонізація — утворення імунних комплексів, що сприяє знищенню антигену неімунними клітинами. Здійснюється за рахунок зв'язування комплексу: 1) з Fс-рецепторами на макрофагах i натуральних кілерах; 2) з компонентами комплементу. Зв'язування антигену призводить до зміни конформації Fс фрагменту, що значно збільшує здатність до 1) і 2) порівняно з вільними антитілами.
Всі підкласи ІgG мають велику шарнірну ділянку, а у ІgG3 вона є дуже видовженою (62 а.к залишки) і містить понад 10 дисульфідних зв’язків.
Підкласи ІgG відрізняються за своїми властивостями: здатністю до спонтанної агрегації, зв'язуванню комплементу. Їх біосинтез регулюється різними механізмами за участі різних типів Т клітин. Інколи присутність певного підкласу ІgG має критичне значення. У людини- ІgG1- 65%, ІgG2-23%, ІgG3-8% і ІgG4- 4%.
 З усіх імуноглобулінів, присутніх в сироватці крові, концентрація ІgG є найбільшою: у неімунізованої тварини – в середньому 10 мг/мл. Для порівняння, концентрація ІgМ у сироватці складає 1,5 мг/мл. Препарати людських ІgG призначаються при імунодефіцитах та при важких вірусних захворюваннях.
З усіх імуноглобулінів, присутніх в сироватці крові, концентрація ІgG є найбільшою: у неімунізованої тварини – в середньому 10 мг/мл. Для порівняння, концентрація ІgМ у сироватці складає 1,5 мг/мл. Препарати людських ІgG призначаються при імунодефіцитах та при важких вірусних захворюваннях.
 | |||
 | |||
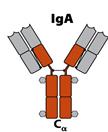 ІgА (15-20% сироваткових Іg)
ІgА (15-20% сироваткових Іg)
Міститься переважно у секретах слизових оболонок: слині, сльозах, поті, молозиві, секретах легенів, шлунково-кишкового тракту та сечо-статевих органів. Існує у вигляді димеру, поєднаного J-joint (єднальним) ланцюгом (15 кДа). У сироватці крові ІgА присутній у мономерній формі. Відомі два підкласи ІgА: ІgАІ (80-90%) та ІgА2, у якого немає дисульфідних зв'язків між важкими і легкими ланцюгами. Аналогічно до ІgМ важкий ланцюг ІgА містить С-кінцевий пептид з 18 а.з. з залишком цистеїну у передостанній позиції. Саме він є залученим у ковалентне зв’язування з J-ланцюгом при утворенні димеру.
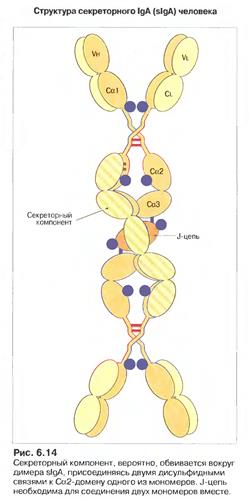
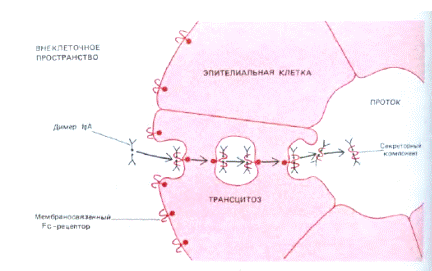
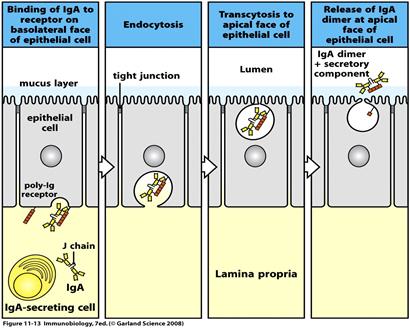
Секреторний sІgА існує у формі димера, чи навіть тримера. Містить крім J-ланцюга ще і секреторний компонент (поліпептидний ланцюг з Мм 60- 70 кДа). Отже ІgА, які синтезуються В-клітинами, зв’язуються попарно за рахунок J-ланцюга. Димери ІgА приєднуються до рецепторів (імуноглобулінові рецептори до зв’язаних J-ланцюгом полімерних імуноглобулінів) на базолатеральній поверхні епітеліальних клітин. Комплекси Іg-рецептор поглинаються шляхом ендоцитозу (інтерналізація), а утворенні ендосоми транспортуються до латеральної поверхні епітеліальної клітини, що межує з оточуючим середовищем. Цей процес отримав назву транцитозу. Після злиття ендосоми з цитоплазматичною мембраною на цьому боці клітини і виведенням комплексу на зовнішню поверхню мембрани відбувається протеоліз рецептора таким чином, що його частина лишається у складі комплексу, утворюючи секреторний компонент. Отже секреторний компонент - це частина рецептору до ІgА на епітеліальній клітині, через яку ІgА проходить із кровоносної чи лімфоїдної судини до слизових оболонок.
Секреторний компонент захищає sІgА від протеолізу та подовжує його строк роботи. sІgА активує комплемент і стимулює фагоцитарну реакцію у слизових.
 | |||
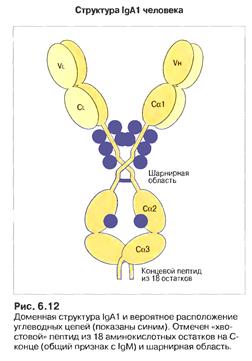 | |||
 Рис. Сироваткова і секреторна форми ІgА
Рис. Сироваткова і секреторна форми ІgА
Секреторний ІgА є головним елементом захисної дії слизової оболонки від нападу мікроорганізмів, а слизові є потенційно найбільшими воротами захисту від інфекцій. До того ж у випадку зараження епітеліальних клітин вірусами ІgА, що транспортується крізь ентероцити, може нейтралізувати останні вже всередині цих клітин.
Рис. Механізм переносу sІgА через епітеліальну клітину
 | ||||
 | ||||
 |
ІgЕ ( до 0,002 % сироваткових Іg)
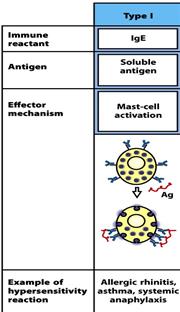
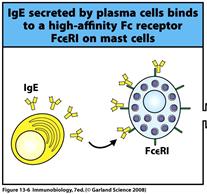
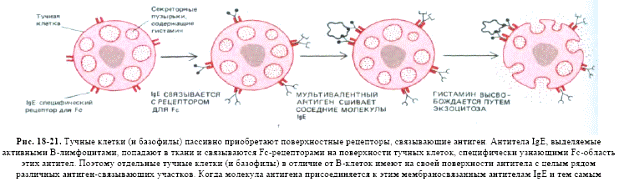
Міститься у сироватці крові, концентрація невелика. Є мономером, та як і для ІgМ, де μ- ланцюг містить чотири Сμ –домени, для ε- ланцюгів це також є характерним (72,5кДа, 550 а.з.). В цьому імуноглобуліні є додатковий Сн4 домен та відсутня шарнірна ділянка, роль якої виконує другий константний домен (Сн2-домен). Основна функція - індукція гострої реакції запалення шляхом звільнення медіаторів запалення: вазоактивних амінів - гістаміну та серотоніну - із тучних клітин в тканинах та базофілів крові. Саме ці клітини несуть на своїй поверхні Fс-рецептори до ІgЕ, а сам процес вивільнення запускається після взаємодії ІgЕ з антигеном. В нормі медіатори запалення викликають розширення кровоносних судин і підвищують проникність їх стінок, що сприяє притоку у місце інфекції (запалення) антитіл ІgG, комплементу, нейтрофілів, еозинофілів для ефективного подолання інфекції. Однак у цьому цілком нормальному механізмі часто трапляється збій, і тоді організм починає раптово відповідати надто сильно, неадекватно, на якийсь незначний і не небезпечний антиген типу пилку рослин чи бджолиної отрути. Тоді виникає алергійна реакція (гіперчутливості 1 типу): анафілактичний шок, сінна лихоманка, бронхіальна астма. ІgЕ - головні медіатори алергії. Також мастоцити і базофіли, як і еозинофіли, беруть участь у захисті організму проти гельмінтів.
 | |||||||
 | |||||||
 | |||||||
 |
ІgD( 2 % сироваткових Іg)
Існують тільки у мембранозв'язаній формі у вигляді рецепторів В лімфоцитів, які ще не зустрілись з антигеном. При розвитку В клітин з'являються після ІgМ. Мають видовжену шарнірну ділянку (70 а.з.), що забезпечує велику рухливість Fab фрагментів і тим самим сприяє ефективному зв’язуванню антигенів. До складу входять короткі С-кінцеві пептиди ("хвостики" на С-кінцях- 8-10 а.з.), збагачені великою кількістю олігоцукрів. ІgD здатні до спонтанного протеолізу, їм належить значна роль в індукуванні дозрівання певних антитіл.
 |
Будова активного центру антитіл (за Скок М.)
Будову активного центру антитіл вивчали різними методами.
1. Фотоафінна та спінова мітка. Принцип: до антигену вводили хімічну групу, яка під дією опромінення утворювала ковалентні зв'язки із амінокислотними залишками, що її оточують. Потім комплекс антиген-антитіло гідролізували і визначали, із якою саме амінокислотою зв'язана мітка. Таким чином було знайдено, що у склад активного центру антитіла входять гіперваріабільні амінокислотні залишки.
2. Було помічено, що зв'язок антиген-антитіло руйнується при зміні рН, іонної сили і при додаванні органічних розчинників чи хаотропних іонів. Так було зроблено висновок, що зв'язок антигену з антитілом не ковалентний, а іонний, водневий чи гідрофобний.
3. Розміри активного центру вивчали за допомогою олігомерів амінокислот і вуглеводів різного розміру. Так було знайдено, що в активному центрі антитіла може поміститися 5-6 залишків амінокислот чи глюкози і розміри активного центру становлять, відповідно, приблизно 15х6х8 Å = 1,5х0,6х0,8 нм (12х20 Å ) і можуть варіювати у різних антитіл.
4. Те, що активний центр - це порожнина, заглиблена у Fv фрагмент, було знайдено за допомогою бівалентного гаптена (два дінітрофенола, розділених різною кількістю метиленових радикалів). При додаванні антитіл до такого антигену під електронним мікроскопом спостерігали характерні кільцеві структури, утворені збігом декількох молекул антитіл, що зв'язали антиген. Такі структури не утворювалися, якщо довжина спейсора була менше за 5(СН2), тобто активний центр був заглиблений у Fv- фрагмент приблизно на 15 Å.
5. І, нарешті, у 70-ті роки було зроблено рентген-структурний аналіз мієломних імуноглобулінів, який підтвердив дані, отримані раніше, і показав, що активний центр антитіла - це порожнина, в утворенні якої беруть участь гіперваріабільні ділянки Fаb фрагменту, зближені у третинній структурі.
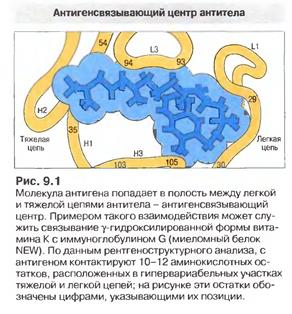
Таким чином, методом рентгеноструктурного аналізу кристалізованих білків було з’ясовано просторову будову варіабельних доменів і активного центру антитіл в цілому. На рис. показано просторову будову V- домену важкого ланцюга IgG людини (мієломного білка New). Упаковка в глобулу поліпептида, що є складовою V- домену, відбувається таким чином, що гіперваріабельні ділянки виявляються у безпосередній близькості один від одного з боку зовнішнього N-кінця. Каркасні ділянки VH- домену містять послідовності, що взаємодіють з тими ж послідовностями у VL –домені при утворенні АГ-зв'язуючого сайту. Отже в уворенні активного центру беруть участь VH- домен і VL –домен, що взаємодіють між собою. А взаємодія мієломного білка New з вітаміном К1ОН (γ-гідроксильованої форми вітаміну К) дозволила розрахувати розміри антигензв'язуючої порожнини для конкретного гаптена: глибина- 0,5-0,6 нм, довжина- 1,6 нм, ширина- 0,7 нм. Середні дані- глибина- 0,6-0,7 нм, довжина- 2,5-3,6 нм, ширина- 1,0-1,7 нм. До 10-12 амінокислотних залишків CDRs легкого і важкого ланцюга контактують з антигеном.
 | |||
 |
Детальні дослідження зв’язування мишачим антитілом D1.3 великого білкового антигену –лізоциму курячого яйця-показали, що АТ контактує з АГ через 17 амін.зал. З них 10 належало важкому, а 6(7) легкому ланцюгу. Вони належали до всіх CDRs, а особливо до CDR3 важкого ланцюга. Дві амінокислоти належали до каркасних ділянок. Площа контакту- 7,5 нм2, що складає 11% від поверхні АТ. Встановлено, що контактуючі поверхні так щільно підігнані, що були витіснені всі молекули води, що гідратували обидва білка. Це сприяло росту ентропії і підвищувало міцність утвореного комплексу.

Рис. Комплекс лізоциму курячого яйця
з антитілом D1.3. Фіолетові-важкі ланцюги;
легкі ланцюги-жовті; лізоцим-блакитний.
Червоним позначено залишок глютамінової
кислоти, що міститься між двома V- доменами
і утворює водневі зв’язки, що стабілізують
взаємодію АГ-АТ.
Основа високої специфічності антитіл полягає у відповідному розташуванні амінокислотних залишків в активному центрі; зміна заряду чи розмірів антигенної детермінанти зменшує ефективність зв'язування.

В традиційних підручниках місце зв’язування антигену в молекулі імуноглобуліну представляють як рівчачок, чи кишеня, в яку занурений антиген. Однак кристалографічні дослідження з використанням рентгенівського випромінення показали, що тільки дуже малі антигени після зв’язування з антитілом можуть бути заглиблені у Fab ділянку. При зв’язуванні великих білкових антигенів поверхня контакту між фрагментом Fab антитіла і антигеном розтягнута і більш плоска. Деколи можна побачити на поверхні Fab фрагмента виступи, що входять в молекулу антигену. "Малий" антиген-флюоресцеїн, може заглибитись на 94% у Fab- фрагмент, а великі білкові АГ контактують з молекулою АТ лише кількома відсотками своєї поверхні.
На основі представлених вище даних можна охарактеризувати термін
паратоп- як ділянку молекули імуноглобуліна, який вступає в безпосередній "хімічний" контакт з поверхнею антигенної детермінанти- епітопа. Отже паратоп виникає в разі зближення варіабельних ділянок в третинній і четвертинній структурі, причому всі 6 гіперваріабельних домени зближуються і утворюють стінки активного центру. Отже механістична модель активного центру: просторова відповідність виступу на молекулі АГ (АГ детермінанти) та впадини на поверхні АТ (антигензв'язуючої ділянки). Тільки при співпаданні цих просторових конфігурацій можливо утворення нековалентних взаємодій між епітопом і паратопом, які забезпечують зв’язування АГ/АТ.
БУДОВА АКТИВНОГО ЦЕНТРУ АНТИТІЛ

На рис. A) продемонстровано активний центр у вигляді кишені (pocket=жовтий), де зв’язується малий гаптен ферроцен (зелений).
B) В антигензв’язуючому центрі знаходиться білковий антиген (вірусу HIV), занурений в жолобок (groove), утворений V-доменами важкого і легкого ланцюга. С) активний центр у вигляді поверхні (surface) зв’язує білковий антиген –лізоцим курячого яйця з залученням всіх 6 CDR обох ланцюгів. D) Великий HIV антиген gp120 утворює комплекс з антитілом у формі виступаючої поверхні (protruding surface), а саме видовжена петля CDR3 антитіла входить у заглибину в молекулі антигену.
Ferrocene is an organometallic compound with the formula Fe(C5H5)2. It is the prototypical metallocene, a type of organometallic chemical compound consisting of two cyclopentadienyl rings bound on opposite sides of a central metal atom. Such organometallic compounds are also known as sandwich compounds.[3] The rapid growth of organometallic chemistry is often attributed to the excitement arising from the discovery of ferrocene and its many analogues. Applications of ferrocene and its derivatives
Ferrocene and its numerous derivatives have no large-scale applications, but have many niche uses that exploit the unusual structure (ligand scaffolds, pharmaceutical candidates), robustness (anti-knock formulations, precursors to materials), and redox (reagents and redox standards).
Дата добавления: 2015-03-03; просмотров: 8058;
