Четвертинна структура
Окремі поліпептидні ланцюги, що входять до складу білкової молекули та характеризуються певними первинною, вторинною і третинною структурами, можуть мати досить слабкі (нековалентні) зв'язки між собою.
Такі субодиниці (або протомери) можуть об'єднатися між собою з утворенням молекули, яку називають мультимером. Просторове впорядкування протомерів в мультимер називається четвертинною структурою. Звичайно при утворенні четвертинної структури відбувається асоціація (об'єднання) парної кількості протомерів (2 або 4, рідше 6, 8, 10, 12 тощо). Класичним прикладом білкової молекули, якій притаманна четвертинна структура, є молекула гемоглобіна, що складається з чотирьох субодиниць (функціонально активних частин білкового мультимера). Як зазначалося макромолекула, вище, об'єднання цих субодиниць в четвертинну структуру, досягається завдяки гідрофобним взаємодіям.
Мал.4.13 Сферична білкова макромолекула
У кінці цього параграфа розглянемо досить просту і водночас дуже корисну модель Фішера-Бреслера-Талмуда, яка дає змогу передбачити форму білкової макромолекули залежно від відношення гідрофільних і гідрофобних груп, що входять до її складу.
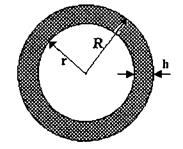
Спочатку знайдемо те співвідношення, виконання якого гарантує сферичну глобулярну структуру білкової макромолекули. Нехай радіус сферичної глобули - 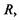 радіус внутрішнього гідрофобного ядра -
радіус внутрішнього гідрофобного ядра - 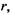 товщина гідрофільного шару -
товщина гідрофільного шару - 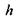 (рис. 4.13). Обчислимо відношення об'ємів гідрофільної та гідрофобної частин в такій сферичній глобулі
(рис. 4.13). Обчислимо відношення об'ємів гідрофільної та гідрофобної частин в такій сферичній глобулі
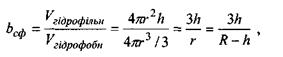 (4.9)
(4.9)
де враховані очевидні рівності для площі поверхні гідрофобного ядра 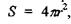 для об'єму гідрофільного шару завтовшки
для об'єму гідрофільного шару завтовшки 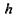 на цьому ядрі
на цьому ядрі 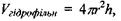 для об'єму самого сферичного гідрофільного ядра
для об'єму самого сферичного гідрофільного ядра 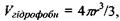 а також для радіуса всієї сферичної глобули
а також для радіуса всієї сферичної глобули 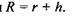
Звідси випливає, що для забезпечення сферичної форми білкової макромолекули повинно виконуватися таке співвідношення для параметра 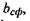 що характеризує відношення об'ємів гідрофільної та гідрофобної частин:
що характеризує відношення об'ємів гідрофільної та гідрофобної частин:
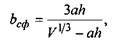 (4.10)
(4.10)
де 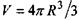 - загальний об'єм сферичної макромолекули, а коефіцієнт
- загальний об'єм сферичної макромолекули, а коефіцієнт 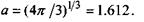
Таким чином, на кривій залежності параметра 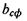 від
від 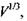 яка відповідає формулі (4.10), розташовуються білкові макромолекули, що мають сферичну форму (рис. 4.14). Якщо параметр
яка відповідає формулі (4.10), розташовуються білкові макромолекули, що мають сферичну форму (рис. 4.14). Якщо параметр 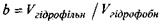 набуває більшого
набуває більшого
значення, ніж те, що визначається формулою (4.10), тобто 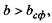 (область над графіком
(область над графіком 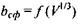 на рис. 4.14), то білкова макромолекула набуває не сферичної, а еліпсоїдальної (фібрилярної) форми. Причина появи фібрилярної структури полягає в тому, що із зростанням кількості гідрофільних амінокислотних залишків вони прагнуть завдяки диполь-дипольним взаємодіям покрити більшу площу, аніж площа сферичної поверхні, яка є мінімальною за величиною при фіксованому об'ємі.
на рис. 4.14), то білкова макромолекула набуває не сферичної, а еліпсоїдальної (фібрилярної) форми. Причина появи фібрилярної структури полягає в тому, що із зростанням кількості гідрофільних амінокислотних залишків вони прагнуть завдяки диполь-дипольним взаємодіям покрити більшу площу, аніж площа сферичної поверхні, яка є мінімальною за величиною при фіксованому об'ємі.
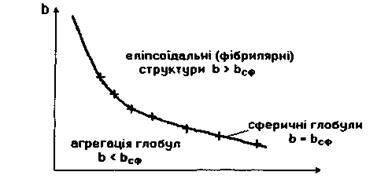
Рис. 4.14. Можливі форми білкових макромолекул в моделі Фішера-Бреслера-Талмуда.
У тому ж випадку, коли 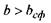 (область під кривою залежності
(область під кривою залежності 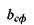 від
від 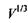 , див. рис. 4.14), кількості гідрофільних груп не вистачає навіть для покриття поверхні сферичної глобули. На сферичній поверхні залишаються гідрофобні області, які повинні "заховатися" від полярного оточення. Тому стає детермінованим процес (ймовірність якого прямує до одиниці) об'єднання глобул з утворенням четвертинної структури. Типовим проявом подібного механізму утворення четвертинної структури є молекула гемоглобіну, що складається, як вже зазначалося, з чотирьох глобул, саме завдяки гідрофобним взаємодіям.
, див. рис. 4.14), кількості гідрофільних груп не вистачає навіть для покриття поверхні сферичної глобули. На сферичній поверхні залишаються гідрофобні області, які повинні "заховатися" від полярного оточення. Тому стає детермінованим процес (ймовірність якого прямує до одиниці) об'єднання глобул з утворенням четвертинної структури. Типовим проявом подібного механізму утворення четвертинної структури є молекула гемоглобіну, що складається, як вже зазначалося, з чотирьох глобул, саме завдяки гідрофобним взаємодіям.
Дата добавления: 2015-03-03; просмотров: 1059;
