Первинна структура
Макромолекули білків і нуклеїнових кислот характеризуються чітко відповідною послідовністю мономерів, а саме: в білках - послідовністю амінокислотних залишків в поліпептидному ланцюгу, в нуклеїнових кислотах - послідовністю окремих нуклеотидів в полінуклеотидному ланцюгу. Окремі ділянки цих ланцюгів, тобто поруч розташовані амінокислоти та нуклеотиди, пов'язані між собою дуже сильними хімічними ковалентними зв'язками, величина яких може досягати 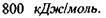 До речі, середня теплова енергія одноатомних молекул при кімнатній температурі
До речі, середня теплова енергія одноатомних молекул при кімнатній температурі 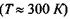 має величину
має величину 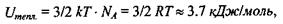 що майже в 220 разів менше, ніж вказана вище енергія зв'язку мономерів в білках та нуклеїнових кислотах.
що майже в 220 разів менше, ніж вказана вище енергія зв'язку мономерів в білках та нуклеїнових кислотах.
Послідовність мономерів (амінокислот в поліпептидному ланцюгу білків та нуклеотидів в полінуклеотидному ланцюгу нуклеїнових кислот) визначає первинну структуру макромолекул. Саме з'ясування первинної структури генетичних макромолекул людини і є головною метою згаданої вище програми "Геном людини", що здавалася фантастичним проектом ще 10 років тому і яка стала дійсністю в 2000 році. І нині вже здаються фантастичними медичні наслідки цієї програми, які можуть стати реальністю через 5-10 років.
Розглянемо більш детально первинну структуру білків, що визначається послідовністю амінокислот. Амінокислоти мають дві частини: 1) однакову для всіх амінокислот пептидну групу; 2) бокову групу (БГ), від якої залежить специфіка амінокислоти. Всього таких різних бокових груп (і відповідно амінокислот) може бути 20. Кожний пептидний блок поліпептидного ланцюга складається з ковалентно пов’язаних атомів 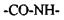 (рис 4.7). До альфа-вуглецевого атома
(рис 4.7). До альфа-вуглецевого атома 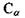 приєднується бокова група також за допомогою ковалентного зв'язку. Різні пептидні блоки із своєю боковою групою з'єднуються в поліпептидний ланцюг внаслідок ковалентного зв'язку між атомом вуглецю
приєднується бокова група також за допомогою ковалентного зв'язку. Різні пептидні блоки із своєю боковою групою з'єднуються в поліпептидний ланцюг внаслідок ковалентного зв'язку між атомом вуглецю 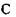 одного пептидного блоку та атомом азоту
одного пептидного блоку та атомом азоту 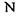 другого пептидного блоку.
другого пептидного блоку.
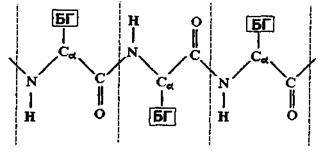
Рис. 4.7. Схема будови поліпептидного ланцюга білкової молекули.
Двадцять амінокислот, що відрізняються своїми боковими групами (амінокислотними залишками), об'єднуються в три класи відповідно до їх фізичних властивостей, що визначаються характером притаманних їм взаємодій. Ця специфіка амінокислот визначає їх просторову структуру, а саме: вторинну, третинну і четвертинну структуру білків.
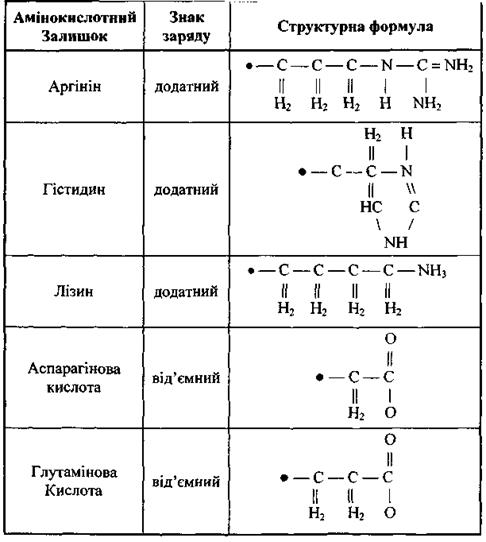
До першого класу віднесемо п'ять заряджених амінокислотних залишків: а) додатно заряджені (аргинін, гістидин, лізин); б) від'ємно заряджені (аспарагінова кислота, глутамінова кислота). У табл. 6.6 наведені структурні формули цих заряджених амінокислотних залишків, що через альфа-вуглецевий атом  (чорне коло) приєднується до пептидної частини амінокислоти. Амінокислотні залишки першого класу здатні на кулонівські (іон-іонні) та інші електростатичні взаємодії (іон-дипольні, іон-квадрупольні тощо).
(чорне коло) приєднується до пептидної частини амінокислоти. Амінокислотні залишки першого класу здатні на кулонівські (іон-іонні) та інші електростатичні взаємодії (іон-дипольні, іон-квадрупольні тощо).
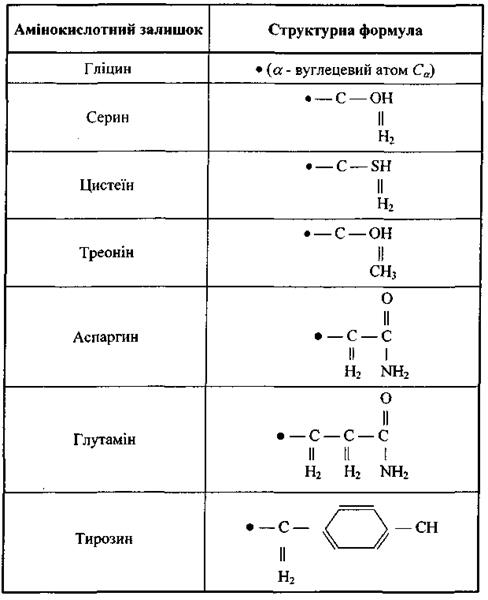
До другого класу відносяться сім полярних амінокислотних залишків, тобто таких, що є, в цілому, електро-нейтральними, але мають дипольний момент через просторове рознесення додатного і від'ємного сумарних зарядів (табл. 4.7). Ці амінокислотні залишки забезпечують диполь-дипольну взаємодію різних типів.
І нарешті, найбільший, третій клас складається з восьми неполярних амінокислотних залишків (табл. 4.8). Для них є характерними ефекти гідрофобної взаємодії.
Первинна структура нуклеїнових кислот визначається послідовністю мономерів (нуклеотидів) в полінуклеїдному ланцюгу. Кожний нуклеотид складається з фосфату і сахару, які пов'язані сильними ковалентними силами і тим самим визначають міцність ланцюга, а також азотних основ двох типів - пуринових (аденін А і гуанін Г) та піримідинових (тимін Т, цитозин Ц і урацил У).
Таблиця 4.6. Заряджені амінокислотні залишки
Таблиця 4.7. Полярні амінокислотні залишки
Видатним досягненням молекулярної біології, яка розвинулася в потужну науку в другій половині XX століття і, безумовно, визначиться як передова наука в XXI столітті, є відкриття та розшифровка генетичної ролі дезоксирибонуклеїнової (ДНК) і рибонуклеїнової (РНК) кислот. Ця роль, коротко кажучи, зводиться до таких процесів:
Таблиця 4.8. Неполярні амінокислотні залишки

1) транскрипція - процес, внаслідок якого інформація, що записана в ДНК, переписується в РНК і передається до рибосомів;
2) трансляція - процес синтезу білків відповідно до інформації, що записана в матричній РНК;
3) білково-нуклеїнове розпізнавання - процес, внаслідок якого вільні амінокислоти приєднуються за допомогою транспортної РНК, яка їх впізнає, до поліпептидного білкового ланцюга.
Дата добавления: 2015-03-03; просмотров: 918;
