Общие сведения. Одна из важнейших закономерностей строения атомных спектров – их сериальная структура
Одна из важнейших закономерностей строения атомных спектров – их сериальная структура. Сериальные закономерности представляют собой яркое проявление квантовых свойств излучающих атомных систем. Линии линейчатого спектра атомов газа, находящегося при низком давлении, могут быть объединены в определенные, закономерно построенные группы – так называемые серии. Длины волн всех линий, принадлежащих к одной и той же серии, связаны между собой. Сериальные закономерности в наиболее простой форме проявляются в спектре одноэлектронного атома водорода, для которого они и были открыты впервые.
Рассмотрим атом водорода и сходные с ним ионы (модель так называемого водородоподобного атома), т. е. предположим, что имеется атомная система, состоящая из ядра с зарядом Ze и одного электрона с зарядом – е, где Z – порядковый номер элемента в периодической системе.
Кулоновская сила f взаимодействия между ядром и электроном играет роль центростремительной силы, равной для круговой орбиты
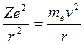 , (1)
, (1)
где 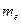 - масса электрона; r – радиус орбиты.
- масса электрона; r – радиус орбиты.
В электрическом поле ядра электрон обладает потенциальной энергией
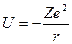 . (2)
. (2)
Полная энергия электрона равна сумме потенциальной и кинетической энергий. С учетом (1) и (2) и знаков в этих выражениях
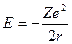 . (3)
. (3)
Согласно представлениям классической электромагнитной теории, вращающийся по орбите электрон возбуждает вокруг себя переменное электромагнитное поле, распространяющееся в пространстве со скоростью света. Иначе говоря, ускоренно движущийся электрон при своем движении вокруг ядра должен излучать и вследствие этого терять часть энергии. Таким образом, согласно классической механике, энергия электрона все время уменьшается. Из формулы (3) следует, что меньшему значению энергии (с учетом знака) соответствует меньший радиус. В результате электрон должен «упасть» на ядро. Из формулы (1) следует, что с уменьшением радиуса орбиты скорость движения электрона возрастает, т. е. период обращения уменьшается. Это должно привести к непрерывному увеличению частоты излучаемых электромагнитных волн, и атом должен излучать непрерывный (сплошной) спектр. Однако в действительности атом – устойчивая система и может излучать лишь линейчатый спектр. Выход из создавшегося противоречивого положения был предложен Бором.
Теория водородоподобного атома. Основываясь на гипотезе Планка о квантовом характере излучения и поглощения, Бор сформулировал законы, описывающие состояние и движение электронов в атоме в виде определенных постулатов, которые дают объяснение экспериментальным данным. Постулаты эти таковы.
1. Электрон в атоме может вращаться только по строго определенным стационарным орбитам, радиусы которых определяются из условия
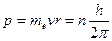 , (4)
, (4)
где p – момент импульса электрона; n – главное квантовое число, принимающее целые положительные значения 1, 2, … и определяющее принадлежность электрона к той или иной орбите; h – постоянная Планка. Все другие орбиты «запрещены». Таким образом Бор постулировал, что энергия электрона в атоме может принимать строго определенные дискретные значения 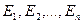 ,…
,…
2. Двигаясь по стационарным орбитам, электрон не излучает и не поглощает электромагнитных волн.
3. Излучение происходит лишь при переходе электрона из стационарного состояния с большим значением энергии 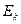 в другое стационарное состояние с меньшим значением энергии
в другое стационарное состояние с меньшим значением энергии 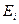 . При этом излучается квант энергии (фотон) строго определенной частоты. Излучение атома монохроматично, и частота его определяется фундаментальным соотношением (условие частот Бора)
. При этом излучается квант энергии (фотон) строго определенной частоты. Излучение атома монохроматично, и частота его определяется фундаментальным соотношением (условие частот Бора)
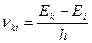 , (5)
, (5)
где 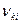 - энергия излученного фотона.
- энергия излученного фотона.
Из соотношения (5) следует, что излучение происходит при переходе электрона с внешних орбит на внутренние. Если же электрон переходит с внутренних орбит на внешние, то энергия поглощается.
Вычислим радиусы стационарных орбит и полную энергию электрона в водородоподобном атоме. С учетом (1) и условия квантования Бора (4) имеем для значений радиусов стационарных орбит и энергий стационарных состояний соответственно
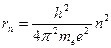 ; (6)
; (6)
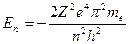 . (7)
. (7)
Из формулы (7) следует, что квантовое число n определяет энергию электрона в атоме, так как остальные величины остаются постоянными.
В общем случае атомная система, состоящая из ядра и одного электрона, переходя из стационарного состояния, характеризуемого главным квантовым числом 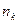 , в состояние с главным квантовым числом
, в состояние с главным квантовым числом 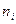 , испускает по условию частот Бора спектральные линии с частотами
, испускает по условию частот Бора спектральные линии с частотами
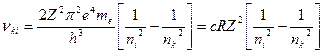 , (8)
, (8)
где постоянная величина
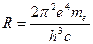 (9)
(9)
называется постоянной Ридберга.
Так как по определению, в терминах волновых чисел 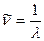 , имеем
, имеем
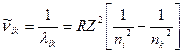 . (10)
. (10)
Этот закон – один из самых точных в физике. Из него прежде всего и следует, что все линии спектра могут быть объединены в серии. Серией называется совокупность спектральных линий, описываемых формулой (10) при 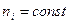 , т. е. серия возникает при переходе электрона с вышележащих орбит на орбиту с заданным квантовым числом
, т. е. серия возникает при переходе электрона с вышележащих орбит на орбиту с заданным квантовым числом 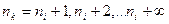 .
.
Формулу (10) можно представить в виде
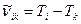 , (11)
, (11)
где 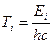 ,
, 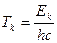 - сериальные термы, пропорциональные значениям энергии атома с точностью до некоторой аддитивной постоянной. В связи с этим приобретает физический смысл и постоянная Ридберга R – это число, пропорциональное энергии атома в основном состоянии.
- сериальные термы, пропорциональные значениям энергии атома с точностью до некоторой аддитивной постоянной. В связи с этим приобретает физический смысл и постоянная Ридберга R – это число, пропорциональное энергии атома в основном состоянии.
В спектр испускания водорода входит несколько серий, расположенных в различных областях спектра:
а) серия Лаймана – крайняя ультрафиолетовая область
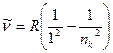 ,
,
где 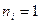 ,
, 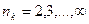 ;
;
б) серия Бальмера – видимая и близкая ультрафиолетовая области
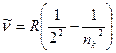 ,
,
где 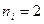 ,
, 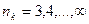 ;
;
в) серия Пашена – инфракрасная область спектра
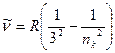 ,
,
где 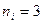 ,
, 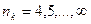 ;
;
г) серия Брэккета – инфракрасная область спектра
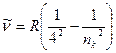 ,
,
где 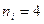 ,
, 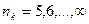 ;
;
д) серия Пфунда – инфракрасная область спектра
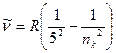 ,
,
где 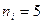 ,
, 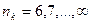 .
.
Схема энергетических уровней атома водорода и соответствующих переходов показана на рис. 1. Как видно из рисунка, головными линиями каждой серии являются линии, частоты которых могут быть рассчитаны по формуле
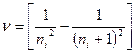 . (12)
. (12)
Заштрихованные переходы соответствуют границе серии и определяются формулой (8), если в ней 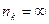 , т.е. их частота выразится в виде
, т.е. их частота выразится в виде
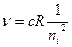 .
.
Особый интерес представляет определение граничной серии Лаймана 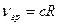 , что следует из сериальной формулы при
, что следует из сериальной формулы при 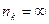 . Зная частоту граничной линии Лаймана, можно определить энергию, необходимую для отрыва электрона от атома водорода, находящегося в нормальном, или в основном, состоянии с
. Зная частоту граничной линии Лаймана, можно определить энергию, необходимую для отрыва электрона от атома водорода, находящегося в нормальном, или в основном, состоянии с 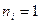 . Эта энергия называется энергией ионизации и вычисляется по формуле
. Эта энергия называется энергией ионизации и вычисляется по формуле
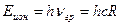 . (13)
. (13)
Для водородоподобного атома
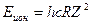 . (14)
. (14)
Таким образом, зная значения констант h, с, R и е, можно вычислить энергию ионизации водородоподобного атома по формуле (14).
Следует подчеркнуть, что имеются различия между экспериментально найденным значение постоянной Ридберга и теоретическим значением, что видно из следующих данных : Rт = 109737,303 см-1; R = 109677,581 см-1. Расхождение объясняется тем, что при выводе формулы (13) ядро водородоподобного атома считалось неподвижным, то есть имеющим бесконечно большую массу. В действительности же ядро имеет конечную массу. С учетом этого в результате взаимодействия движущегося электрона с ядром (протоном) происходит движение обеих частиц вокруг общего центра инерции атома. В формулу для постоянной Ридберга вместо массы электрона те войдет приведенная масса 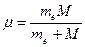 , где M - масса ядра. Следовательно, энергия стационарного состояния и постоянная Ридберга должны зависеть от массы ядра
, где M - масса ядра. Следовательно, энергия стационарного состояния и постоянная Ридберга должны зависеть от массы ядра
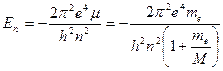 , (15)
, (15)
то есть
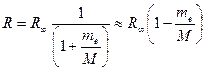 , (16)
, (16)
где 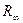 - постоянная Ридберга, вычисленная в предположении бесконечно тяжелого ядра.
- постоянная Ридберга, вычисленная в предположении бесконечно тяжелого ядра.
Дата добавления: 2015-02-25; просмотров: 1113;
