Понятие процесса ректификации
Ректификация — сложный массотеплообменный процесс разделения жидких смесей, состоящих из нескольких взаиморастворимых компонентов. Ректификация основана на многократном частичном испарении жидкости и конденсации ее паров или на однократном испарении смеси с последующей многоступенчатой конденсацией компонентов.
Ректификация — наиболее совершенный и распространенный способ перегонки растворов. Перегонка основана на различной температуре кипения компонентов жидкости. Так, если жидкость является бинарной, то есть состоит из двух компонентов, например бензола с температурой кипения 80° С и толуола с температурой кипения 110° С, то при перегонке этой жидкости пар будет содержать большее количество низкокипящего компонента (бензола). Следовательно, в процессе перегонки жидкая фаза обедняется, а паровая фаза обогащается низкокипящим компонентом (бензолом).
Ректификация позволяет производить глубокое разделение смесей и получать компоненты в чистом виде. Она нашла широкое применение в химической, нефтехимической, нефтеперерабатывающей, пищевой и других отраслях промышленности.
Ректификация представляет собой процесс многократного частичного испарения жидкости и конденсации паров. При каждом цикле «испарение — конденсация» из жидкости испаряется преимущественно низкокипящий (летучий) компонент, которым обогащаются пары, а из паров конденсируется преимущественно высококипящий компонент (труднолетучий), переходящий в жидкость. Такой процесс обмена компонентами между жидкостью и паром, повторяемый многократно, в конечном счете позволяет получить пары почти чистого низкокипящего компонента. Эти пары после конденсации в отдельном аппарате дают готовый продукт — ректификат. Остаток жидкости после испарения из него низкокипящего компонента представляет собой почти чистый высококипящий компонент.
Ректификация осуществляется в специальных аппаратах — ректификационных колоннах, которые являются основными элементами ректификационных установок.
Ректификационные колонны сложны по устройству, имеют большие габариты, пожаровзрывоопасны. Чтобы правильно оценить их пожаровзрывоопасность и обеспечить противопожарную защиту, следует знать их устройство, понимать суть процессов, в них происходящих.
Сущность процессов перегонки и ректификации рассмотрим на примере разгонки смеси бензол — толуол (с использованием графических зависимостей состава пара и жидкости от температуры кипения раствора): диаграммы t — х, у (температура — состав) и диаграммы у — х (состав пара — состав жидкости).
На рис. 13.1 представлена диаграмма t — х, у для смеси бензол—толуол.
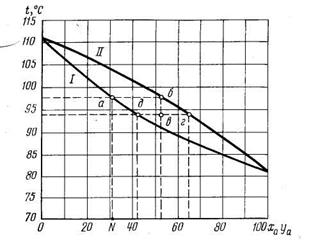
Рис. 13.1. Изобарные кривые кипения и конденсации паров; I—кривая кипения раствора; //—кривая конденсации пара; ха — молекулярная доля легкокипящего компонента (бензола); уа — молекулярная доля легко-кипящего компонента в паровой фазе
Диаграмма имеет две ветви: нижняя представляет линию кипения жидкости, каждая точка которой отвечает температуре кипения смеси состава ха; верхняя — представляет линию конденсации пара, каждая точка которой отвечает температуре конденсации пара состава уа. По оси ординат отложена температура в градусах Цельсия, по оси абсцисс — молекулярная доля бензола (легкокипящего компонента) в растворе ха и молекулярная доля бензола в паровой фазе уа.
При пользовании диаграммой t — х, у на оси абсцисс находят состав жидкой смеси ха и из этой точки проводят вертикаль до пересечения с линией кипения. Точка пересечения указывает температуру кипения этой смеси. Если провести горизонталь до пересечения с линией конденсации, абсцисса точки пересечения укажет состав равновесного пара уа.
Например, пусть жидкость имеет концентрацию бензола 32% мольных (точка N). Процесс нагревания идет по вертикали до пересечения с линией кипения. В точке а жидкость закипит при 98° С. Образующийся равновесный пар будет иметь концентрацию, соответствующую точке б, находящейся на кривой конденсации. Абсцисса этой точки равна 53% мольным. Значит, уа = 53% мольных. Следовательно, при кипении раствора образующийся пар богаче легколетучим компонентом (по сравнению с кипящей жидкостью).
Если получающиеся при кипении пары отбирать и конденсировать, можно достигнуть частичного разделения раствора. Такое разделение растворов называют простой перегонкой.
Если получающийся при кипении пар частично сконденсировать, жидкость, получающаяся при конденсации, и оставшийся не-сконденсированным пар будут иметь разный состав. Пар будет содержать больше легкокипящего компонента, чем конденсат. Следовательно, при частичной конденсации происходит обогащение оставшегося (несконденсированного) пара легколетучим компонентом.
Допустим, исходный пар (см. рис. 13.1) имеет концентрацию бензола 53% мольных (точка б на кривой II). Охладим его" до 94°С (точка в). При этом часть пара сконденсируется; получится дистиллят, концентрация которого будет равна 43% мольным (точка д на кривой I). Оставшийся пар будет иметь концентрацию бензола 65% мольных (точка г на кривой II). Этот процесс, называемый перегонкой с дефлегмацией пара, также позволяет достигнуть частичного разделения растворов
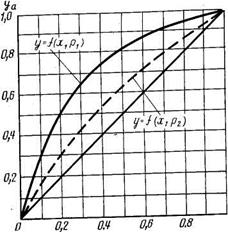
Рис. 13.2. Кривые равновесия фаз (p2>р1): ха — молекулярнаядоля легкокипящего компонента в растворе;
уа — молекулярная доля легкокипящего компонента в паровой фазе
При расчетах процессов ректификации обычно используют кривые фазового равновесия в виде диаграмм у — х (состав пара — состав жидкости). На рис. 13.2 представлена диаграмма у — х для жидкостей, растворимых в любых отношениях (типа бензол — толуол). По оси ординат откладывают мольную концентрацию легколетучего компонента в паре, по оси абсцисс — мольную концентрацию легколетучего компонента в жидкости. Диаграмму у—х можно построить, используя диаграмму t—x, у. Для ряда значений концентраций ха находят соответствующие равновесные значения концентраций уа (необходимо из точки на абсциссе, соответствующей ха, по вертикали подняться до пересечения с кривой кипения I; по горизонтали следует дойти до кривой конденсации II, а затем опуститься по вертикали до оси абсцисс и прочитать значение уа). Полученные точки наносят на диаграмму у—х и соединяют плавной кривой.
Применительно к идеальным растворам (подчиняющимся закону Рауля) кривые фазового равновесия можно построить на основе расчета. Для каждой температуры кипения раствора определяют молекулярную концентрацию легкокипящего компонента врастворе по уравнению
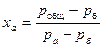 , (13.1)
, (13.1)
где ра и рб — давление насыщенного пара компонентов а и б над чистой жидкостью;
рОбщ — общее давление пара над раствором, равное сумме парциальных давлений его компонентов.
По значению ха определяют парциальное давление легкокипящего компонента в паре:
p’а=pаxа. (13.2)
По величине парциального давления находят молекулярную концентрацию легкокипящего компонента в паре:
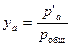 . (13.3)
. (13.3)
Найденные значения ха и уа наносят на график диаграммы у—х и получают плавную кривую.
При расчетах процессов ректификации обычно используют диаграммы у—х, соответствующие атмосферному давлению. При других давлениях каждому значению давления соответствует своя кривая равновесия.
Дата добавления: 2015-02-23; просмотров: 7416;
