Химического воздействия
Обращающиеся в технологическом процессе вещества и окружающая среда вступают в химическое взаимодействие с материалом, из которого изготовлено технологическое оборудование, вызывая его разрушение. Разрушение материала в результате взаимодействия с соприкасающейся с ним средой называется коррозией.
Явление коррозии чаще всего наблюдается в производствах, связанных с использованием азотной, серной, соляной кислот, уксусной кислоты и уксусного альдегида, в процессах добычи, хранения и переработки сернистых нефтей, в процессах электролиза, во время обработки жидкостей и газов, в состав которых входят галоидоводороды, кислоты, щелочи, хлористые и сернистые соли. Значительной коррозии подвержены теплообменные поверхности, омываемые пламенем, подземные и подводные части аппаратов и трубопроводов, а также аппараты и трубопроводы, находящиеся во влажной среде.
Разрушающему действию коррозии наиболее подвержены слабые места производственного оборудования: швы, разъемные соединения, прокладки, места изгибов и поворотов труб.
Коррозионную стойкость металлов оценивают в соответствии с ГОСТ 13819—68 «Коррозионнная стойкость металлов» по десятибалльной системе (табл. 4.2).
Таблица 4.2
| Группа стойкости | Скорость коррозии, мм/год | Балл |
| Совершенно стойкие | Менее 0,001 | |
| Весьма стойкие | 0,001...0,005 0,005...0,01 | |
| Стойкие | 0,01...0,05 0.05..0.1 | |
| Пониженно стойкие | 0,1—0,5 0,5... 1,0 | |
| Малостойкие | 1.0...5.0 5,0..10,0 . | |
| Нестойкие | 10,0 |
Под скоростью коррозии понимают проникновение коррозии в глубину металла и рассчитывают ее (согласно данным о потере массы после удаления продуктов коррозии) по формуле П—Δg/ρ, где Δg — потери массы; ρ — плотность металла.
При расчете оборудования на прочность предусматривают увеличение расчетной толщины стенки аппарата для компенсации потерь от коррозии, то есть принимают
S = Sσ +ΔSK0p, где Sσ — расчетная толщина стенки аппарата (из условий прочности металла) без учета коррозии; ΔSK0p — прибавка на коррозию. ΔSK0p = Пτ, где τ — продолжительность эксплуатации оборудования.
Коррозия причиняет народному хозяйству значительный ущерб, поэтому защита от нее имеет огромное значение. Существует понятие химической коррозии и электрохимической коррозии.
Химическая коррозия наблюдается в среде жидких диэлектриков или газов, нагретых до высоких температур. Это окислительно-восстановительный химический процесс, к которому относят кислородную, сероводородную, серную,а также водороднуюи некоторые другие виды коррозии в аппаратах с температурными режимами от 200° С и выше.
При взаимодействии стали с кислородом воздуха (при повышенной температуре) образуется окалина — окислы металла:
4Fe + 3O2→2Fe2O3. (4.15)
Окалина не обладает механической прочностью и легко отслаивается от металла. Скорость окисления увеличивается с повышением температуры и концентрации кислорода.
Серная и сероводородная коррозия наблюдается при переработке сернистого сырья в нефтеперерабатывающей, нефтехимической, химической, коксобензольной и газовой отраслях промышленности, а также при производстве серы и сероуглерода. Коррозия происходит под действием элементарной серы с образованием сернистого железа. Сера может находиться как примесь в основном продукте, но чаще получается в результате окисления или термического разложения сернистых соединений и сероводорода. В аппаратах, работающих при 310° С и выше (печи, колонны, реакторы и т. п.), происходит диссоциация сероводорода с образованием элементарной серы, которая и взаимодействует с металлом:
H2S→H24+S (термическая диссоциация); (4.16)
2H2S + O2→2H2O + 2S (окисление); (4.17)
Fe+S→FeS (коррозия). (4.18)
Сернистое соединение железа — пористое вещество, не обладающее механической прочностью и, кроме того, легко окисляющееся на воздухе с выделением значительного количества тепла, способного нагреть сульфиды до их самовозгорания.
Водородная коррозия, характерная для процесса производства аммиака, процессов гидрогенизации, гидроочистки и риформинга нефтепродуктов, особенно сильно проявляется при высоких давлениях и температурах. Водородная коррозия относится к межкристаллитному типу. Установлен следующий механизм разрушения металла водородом. Диффузия водорода происходит в толщу металла по границам структурных зерен. При этом наблюдается частичное растворение водорода и химическое взаимодействие его с цементитом стали по следующей реакции:
Fe3C+2H2→CH4+3Fe. (4.19)
Этот процесс сопровождается разрушением структуры зерна и образованием мелких трещин. Образование трещин объясняется обезуглероживанием и тем, что удельный объем железа меньше удельного объема цементита. В образовавшиеся трещины проникает водород, вызывающий продолжение и ускорение процесса коррозии. Металл становится хрупким, его сопротивляемость удару и изгибу падает.
Электрохимическая коррозияпредставляет собой процесс растворения металлов в электролитах в результате действия образующихся гальванических пар. Сущность процесса совпадает с работой гальванического элемента. Если металл не является однородным, отдельные его участки обладают различной способностью к: растворению. Чем левее расположен металл в ряду напряженности, тем легче он растворяется в электролите. Отдельные участки поверхности аппарата, соприкасаясь с электролитом, будут служить, анодом, другие — катодом. Схема коррозионного процесса, происходящего по указанному механизму, представлена на рис. 4.12.
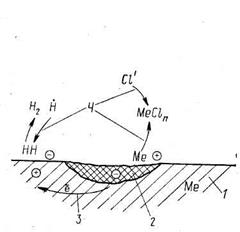
Рис. 4.12. Схема электрохимической коррозии: 1 — катодный участок; 2 — анодный участок; 3 — поток электронов в металле; 4 — поток ионов в электролите (раствор соляной кислоты)
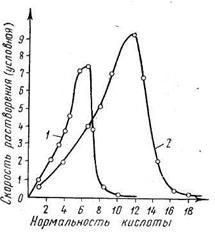
Рис. 4.13. Зависимость растворений стали от концентрации кислот: 1 — азотная кислота; 2— серная кислота
Если неоднородный металл (например, железо плюс включения) поместить в электролит (например, в раствор соляной кислоты), то ионы более активного металла будут переходить в раствор. Участок оборудования, поверхность которого служит анодом, будет разрушаться. Отрицательные ионы электролита (в данном случае ионы хлора) перемещаются в направлении выделяющихся положительно заряженных ионов металла и, соединяясь с ними, образуют хлористую соль металла. В то же время положительно заряженные ионы электролита (водорода) перемещаются к отрицательно заряженным участкам стенки и, нейтрализуясь, образуют молекулу водорода.
Количество растворившегося металла определяют по формуле
Δg=Aiτ/Фn, (4.20)
где Δg — коррозионные потери массы металла; i — коррозионный ток; Ф — постоянная Фарадея, равная 96 500 кулонам; А—атомный вес металла; п — валентность иона металла, переходящего в раствор; τ — время коррозии.
Возникновение коррозии вызывается не только неоднородностью металла, но и многими другими причинами (неодинаковые деформации и напряжения в различных участках, неоднородность концентрации электролита, различные температуры отдельных участков и т. д.). На рис. 4.13 показана скорость электрохимического растворения стали. Она зависит от концентрации электролита. С повышением температуры скорость коррозии увеличивается.
Дата добавления: 2015-02-23; просмотров: 1316;
