VI. Методы, основанные на модификации генетической информации.
Эта группа методов используется для определения структуры и функций генов. Модификация генетической информации приводит к утрате или приобретению генов, что сопровождается изменением фенотипа. Заключение о функции гена делают на основании результатов сравнительного изучения фенотипических признаков, присущих исходному и генетически модифицированному микроорганизму.
1. Конъюгация.Используют для картирования генома – определения местоположения генов и расстояния между ними. Способность к конъюгации клеток определяется присутствием плазмиды фертильности – F-плазмиды, которая кодирует конъюгативные пили. F плазмида может интегрировать в бактериальную хромосому, и в таком состоянии носит название Hfr. После образования конъюгационной пары, Hfr фактор инициирует перенос копии бактериальной хромосомы донора в реципиентную клетку, при этом в последнюю очередь переносится в составе бактериальной хромосомы Hfr фактор. Так как перенос всей хромосомы продолжается при 370С около 100 мин, то прерывая конъюгацию в разное время, можно определить какие гены и в какой последовательности попадают в клетку реципиента. Впервые метод использован Жакобом и Вольманом в 1964 году для построения генетической карты Е.coli (рис. 39).
Мин
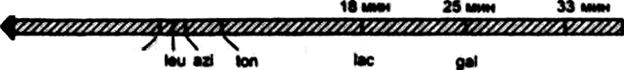
Thr
Trp
Рис. 39.Первая карта участка хромосомы E.coli, построенная Жакобом и Вольманом в 1964 г. на основании определения времени переноса соответствующего гена из донорской клетки в реципиентную
Постановка опыта конъюгации. Для постановки классического опыта конъюгации используют взаимно дополняющие друг друга по двум признакам донорский и реципиентный штаммыE. coli (табл. 15).Бульонные культуры донора и реципиента объемом 0,5 мл смешивают, смесь инкубируют 30 мин при 370С. Для выделения рекомбинантных клеток, смесь высевают наминимальную (глюкозосолевую) среду со стрептомицином. В качестве контроля на среду засевают донорский и реципиентный штаммы, которые не способны расти на ней, так как первый штамм чувствителен к стрептомицину, а второй – не синтезирует лейцин. После подсчёта выросших колоний рекомбинантов определяют частоту рекомбинаций, равную отношению количества рекомбинантных клеток к реципиентным.
Таблица 15
Характеристика штаммов E. сoli, участсвующих в процессе конъюгации
| Свойства | E. coli | ||
| донор (F+,leu+, strs) | реципиент (F-, leu-, strr) | рекомбинант (F+, leu+, strr) | |
| Наличие F-плазмиды | да | нет | да |
| Синтез лейцина | да | нет | да |
| Устойчивость к стрептомицину | нет | да | да |
| Рост на минимальной среде (без лейцина) со стрептомицином | нет | нет | да |
2. Трансдукция– горизонтальный перенос генов от донора к реципиенту умеренными бактериофагами.
Для доказательства существования трансдукции может быть приведен опыт по горизонтальному переносу от донора к реципиенту геновβ-галактозидазного оперона, контролирующего расщепление лактозы у Е. coli. Для проведения опыта необходимы:
-реципиент - штамм E. coli, лишенный β-галактозидазного оперона (E. coli lac-), на среде Эндо образует бесцветные колонии;
- трансдуцирующий фаг - фаг (λ dgal), в геноме которого часть генов замещена генами β-галактозидазного оперона E. coli. Концентрация фага - 106-107 частиц в 1 мл;
- селективная среда Эндо, на которой лактозоотрицательные колонии бесцветны, а лактозоположительные колонии - ярко малиновые, с металлическим оттенком.
Постановка опыта трансдукции. Смешивают по 1 мл трехчасовой бульонной культуры реципиента и трансдуцирующего фага. Смесь инкубируют 60 мин при +370С, готовят серию десятикратных разведений. Из пробирки с разведением 10-6 по 0,1 мл культуры высевают на среду Эндо и инкубируют в течение суток. Рекомбинантные клетки растут с образованием малиновых с металлическим оттенком колоний. Частота трансдукций равна отношению количества клеток рекомбинантов к числу реципиентов.
3. Трансформация - горизонтальный перенос генов от донора к реципиенту через внешнюю среду; осуществляемый после гибели бактерий-доноров.
Для проведения опыта необходимы следующие материалы:
-реципиент - штамм Bacillus subtilis (strs), чувствительный к стрептомицину;
- ДНК донора – выделяют из штамма B. subtilis (strr), устойчивого к стрептомицину;
- селективная среда - МПА со стрептомицином.
Постановка опыта трансформации. Смешивают по 1мл бульонной культуры B. subtilis и ДНК донора. Инкубируют 30 мин при +370С, и высевают на МПА и МПА со стрептомицином. Рекомбинантные штаммы способны расти на селективной среде со стрептомицином. Частота трансформаций равна отношению количества рекомбинантных клеток к реципиентным.
4. Сайт-специфический мутагенез. Это совокупность молекулярно-генетических методов, которые позволяют создавать мутации в определенном участке ДНК. Для этого метода необходимо знание первичной структуры исследуемой ДНК, т.е. она должна быть секвенирована. Метод впервые описан в 1978 году Микаэлем Смитом, который в 1993 году получил Нобелевскую премию.
Этапы сайт-специфического мутагенеза:
а) создание множественных мутантных копий изучаемого гена при помощи ПЦР. Мутантные копии гена получают путем введения мутантных последовательностей в состав праймера, поэтому образуемые в ПЦР копии гена несут известную мутацию (например, чувствительность к ампициллину).
б) внесение полученных копий мутантного гена в клетку-реципиент с помощью плазмидного вектора с двойной фенотипической меткой (например, генами устойчивости к тетрациклину и ампициллину). Изучаемый клонированный ген вводят в плазмидный вектор в месте нахождения гена устойчивости к ампициллину. Плазмидный вектор используют в качестве средства доставки клонированного гена в реципиентную клетку. Доставка осуществляется путем электропорации (трансформации под действием мощного электрического разряда) реципиентных клеток.
В случае успешно проведенного клонирования реципиентные клетки проявляют чувствительность к ампициллину и приобретают устойчивость к тетрациклину.
в) селекция мутантов с помощью метода реплик и использования сред с ампициллином и тетрациклином.
5. Методы селекции мутантов.Для выделения мутантов используют:
а) посев на минимальные среды, лишенные одного из ростовых компонентов. На этих средах растут микроорганизмы, способные синтезировать недостающий компонент.
б) посев на селективные среды, содержащие ингибирующие добавки, способствующие избирательному росту устойчивых к ним микроорганизмов. В качестве ингибирующих добавок могут выступать антибиотики, соли, анилиновые красители, желчные кислоты. На этих средах растут микроорганизмы, обладающие факторами устойчивости к ингибирующему агенту.
 в) посев методом реплик одновременно большого количества изучаемых микроорганизмов (25, 50, 96 культур) при помощи штампа-репликатора. Этапы метода реплик:
в) посев методом реплик одновременно большого количества изучаемых микроорганизмов (25, 50, 96 культур) при помощи штампа-репликатора. Этапы метода реплик:
- внесение тест-культур в лунки донышка штампа-репликатора;
- инокуляция штифтов штампа репликатора тест-культурами (штифты опускают в лунки);
- посев на среду методом отпечатков;
- культивирование и учет результатов (рис. 40). На простой ростовой среде вырастают все микроорганизмы, в то время как на селективной среде - только мутантные микроорганизмы, устойчивые к ингибирующему агенту.
г) использование биосенсоров – молекул-репортеров, которые сообщают о присутствии микроорганизма, его антигенов, метаболитов и т.д.
Дата добавления: 2015-02-23; просмотров: 3854;
