Перший закон термодинаміки
Великий інтерес становить проблема: а який вигляд має вираження закону збереження енергії для систем, в яких істотну роль відіграють теплові процеси. Для вивчення таких процесів існує термодинамічний метод, який не враховує внутрішню будову речовин тіл (систем), що вивчаються, і характер руху окремих частинок. Термодинамічний метод базується тільки на вивченні різних перетворень енергії, що відбуваються в системі. Умови цих перетворень і співвідношення між різними видами енергії дозволяють вивчати фізичні властивості досліджуваних систем у найрізноманітніших процесах, у яких ці системи беруть участь. Розділ фізики, у якому фізичні властивості систем вивчаються за допомогою термодинамічного методу, називається термодинамікою.
Термодинаміка вивчає макроскопічні процеси в тілах, тобто такі явища, які пов'язані з колосальною кількістю атомів і молекул, що містяться в тілах.
Термодинаміка, або загальна теорія теплоти, є аксіоматичною наукою. Вона не вводить ніяких спеціальних гіпотез і конкретних уявлень про будову речовини й фізичну природу теплоти. її висновки ґрунтуються на загальних принципах або началах, що є узагальненням дослідних фактів. Вона розглядає теплоту як вид якогось внутрішнього руху, але не намагається конкретизувати, що це за рух.
Термодинаміка є однією з найважливіших частин фізики. її висновки достовірні настільки, наскільки достовірні аксіоми, на яких вона побудована. Ці висновки використовуються у всіх розділах макроскопічної фізики: гідродинаміці, теорії пружності, аеродинаміці, ученні про електричні й магнітні явища, оптиці й т.д.
Термодинаміка виникла в першій половині XIX століття як теоретична основа теплотехніки, що почала розвиватися в той час. її первісним завданням було вивчення закономірностей перетворення теплоти в механічну роботу в теплових двигунах і дослідження умов, за яких таке перетворення є найбільш оптимальним. Саме таку мету поставив перед собою французький інженер і фізик Саді Карно (1796-1832) у творі "Про рушійну силу вогню і про машини, здатні розвивати цю силу" (1824 p.), де вперше було закладено основи термодинаміки, хоч і збереглися старі помилкові погляди на теплоту як на якусь невагому речовину — теплород, який не можна ні створити, ні знищити. Пізніше термодинаміка вийшла далеко за межі зазначеної технічної задачі. Центр ваги перемістився на вивчення фізичних питань. Основний зміст сучасної фізичної термодинаміки — вивчення закономірностей теплової форми руху матерії і пов'язаних з нею фізичних явищ. Додатки до теплових двигунів, холодильних установок та інших питань теплотехніки виділилися в самостійний розділ, який називається технічною термодинамікою.
Теплова форма руху матерії — це хаотичний рух атомів і молекул у макроскопічних тілах. її специфічність пов'язана з колосальною кількістю атомів і молекул у всякому макроскопічному тілі. Так, в одному кубічному метрі повітря за нормальних умов міститься близько 2,7 • 1025 молекул.
У процесі теплового руху молекули зіштовхуються між собою і зі стінками посудини, в яку вміщено систему. Зіткнення супроводжуються різкими змінами модуля й напрямку швидкостей молекул. У результаті в системі виникає цілком безладний рух, в якому з однаковою імовірністю можна виявити всі напрямки швидкостей молекул, а самі швидкості змінюються в широких межах від дуже малих до дуже великих значень.
Середня швидкість теплового руху газових молекул дуже велика. Для молекул повітря вона становить при кімнатній температурі майже 500 м/с і з підвищенням температури зростає. Зіткнення між молекулами газу відбуваються надзвичайно часто. Наприклад, молекула повітря за нормальної щільності встигає в середньому пройти всього близько 10~4 мм від одного зіткнення до наступного. Знаючи середню швидкість молекули, неважко підрахувати, що при нормальній температурі й щільності молекула повітря за одну секунду зазнає до 5 тисяч зіткнень, причому число зіткнень зростає зі збільшенням температури й щільності газу. Крім поступального руху, відбувається безладне обертання молекул, а також внутрішні коливання атомів, з яких вони складаються. Усе це створює картину надзвичайно хаотичного стану, в якому знаходиться сукупність величезної кількості молекул газів, а також рідких і твердих тіл. Така природа теплоти з погляду молекулярно-кінетичної теорії будови речовини.
Для того, щоб охарактеризувати різний ступінь нагрітості тіл, у термодинаміку вводиться поняття температури.
Уявлення про температуру, як і уявлення про силу, увійшло в науку за посередництвом нашого чуттєвого сприйняття. Наші відчуття дозволяють розрізняти якісні градації нагрітості: теплий, холодний, гарячий й ін. Однак кількісна міра ступеня нагрітості, придатна для науки, не може бути встановлена за допомогою чуттєвого сприйняття. Відчуття суб'єктивні. Залежно від стану руки те саме тіло на дотик може здаватися або теплим, або холодним. Зануримо, наприклад, одну руку в гарячу, а іншу в холодну воду й потримаємо їх там протягом деякого часу. Потім обидві руки опустимо у воду з кімнатною температурою. Тоді перша рука відчує холод, а друга тепло.
Кількісне визначення температури й побудова точної температурної шкали повинні базуватися на об'єктивних фізичних явищах і фактах, вільних від суб'єктивізму чуттєвого сприйняття. Трактувати поняття температури можна з різних точок зору. У феноменологічному вченні про теплоту температура вводиться через поняття теплової, чи термічної, рівноваги. Більш загальним є поняття термодинамічної рівноваги. Як тому, так і іншому поняттю важко дати логічне визначеннюя До них приходять у результаті розгляду конкретних прикладів і наступного узагальнення.
Якщо два тіла, температури яких при оцінюванні за допомогою наших органів чуття значно відрізняються між собою, привести до зіткнення одне з одним (наприклад, розпечений метал і холодну воду), то, як показує досвід, одне тіло буде нагріватися, а інше охолоджуватися, поки в системі не припиняться будь-які макроскопічні зміни.
Тоді, застосовуючи термінологію, запозичену з механіки, говорять, що ці два тіла перебувають у стані термодинамічної рівноваги одне з одним і мають однакові температури. Термодинамічна рівновага, як показує досвід, зрештою настає не тільки у випадку зіткнення двох, але й у випадку зіткнення скількох завгодно тіл.
Відзначені факти допускають узагальнення. Назвемо ізольованою, або замкнутою, системою систему тіл, які не можуть обмінюватися енергією з навколишніми тілами. Тоді, яким би не був початковий стан тіл ізольованої системи, у ній, зрештою, встановиться термодинамічна рівновага, у якій припиняться всі макроскопічні процеси. Це положення відіграє важливу роль у термодинаміці і є одним з найважливіших постулатів, який іноді називають загальним началом термодинаміки.
Наведемо ще кілька прикладів стосовно встановлення термодинамічної рівноваги. Припустимо, що тверду оболонку, яка не проводить тепло, розділено перегородкою, яка теж є теплонепровідною, на дві частини. В одній із частин знаходиться рідина, в іншій створено вакуум. Швидко видалимо перегородку. Рідина закипить. У просторі, обмеженому оболонкою, виникає складний рух рідини і її пари. Але, зрештою, він, а також подальше пароутворення рідини припиняться. Одержимо або тільки одну пару (якщо рідини спочатку було мало), або систему, що складається з рідини й насиченої пари. В обох випадках кінцевий стан є станом термодинамічної рівноваги. Це не є стан абсолютного спокою, в якому припиняються всі без винятку процеси. Якщо розглядати цей стан з молекулярної точки зору, то йому властивий невпинний та інтенсивний обмін молекулами між рідиною і парою. Це означає, що безупинно відбувається процес пароутворення рідини й зворотний до нього процес конденсації пари в рідину. Однак у стані термодинамічної рівноваги ці два процеси в цілому як би взаємно компенсують себе: середня кількість молекул, що випаровуються, дорівнює середній кількості молекул, що повертаються з пари назад у рідину. Термодинамічна рівновага, таким чином, — це така динамічна рівновага, коли дуже інтенсивно відбуваються процеси молекулярного масштабу, але всі макроскопічні процеси припиняються. Це стосується будь-якої термодинамічної рівноваги, а не тільки рівноваги, розглянутої в наведеному прикладі.
Якщо в склянку з водою кинути шматок цукру, то початковий стан системи буде термодинамічно нерівноважним — цукор почне розчиняться в рідині. Однак через деякий час, коли процес розчинення припиниться, установиться термодинамічно рівноважний стан; ми матимемо або однорідний розчин, або неоднорідну систему, що складається зі шматка цукру й насиченого розчину навколо нього. В останньому випадку динамічний характер рівноважного стану виявляється в тому, що процес розчинення цукру, якщо його розглядати з молекулярної точки зору, ніколи не припиняється. Однак у стані рівноваги він компенсується зворотним процесом кристалізації цукру з розчину.
Таким чином, за визначенням, два тіла перебувають у тепловій рівновазі одне з одним або мають однакові температури, якщо в разі теплового контакту між ними рівновага не порушується.
Температура — одна з величин, що залежать тільки від внутрішнього стану тіла.
Нижче на основі другого закону термодинаміки буде показано, як визначається температурна шкала, що не залежить від властивостей тіла, обраного для вимірюванг ня температури.
Абсолютна температура пропорційна середній кінетичній енергії поступального руху молекул речовини. Саме в цьому полягає фізичний зміст температури.
Температура є термодинамічним параметром, або параметром стану системи. Крім температури, термодинамічними параметрами системи є тиск р і об'єм системи V.
Параметри стану p, V, Т системи, що перебуває у стані термодинамічної рівноваги, не є незалежними. Дослідним шляхом можна одержати функціональну залежність рівноважного тиску р у системі від об'єму й температури
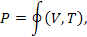 тобто одержати рівняння стану системи.
тобто одержати рівняння стану системи.
Якщо один з параметрів системи змінюється, то відбувається зміна стану термодинамічної системи; ця зміна стану дістала назву термодинамічного процесу
Ізопроцесами називаються термодинамічні процеси, що відбуваються в системі з постійною масою при якому-небудь одному постійному параметрі стану.
Ізотермічний процес відбувається за умови постійної температури (T- const).
Ізохоричний (ізохорний) процес відбувається за умови постійного об'єму (V = const).
Ізобаричний (ізобарний) процес протікає за умови постійного тиску (р = const).
Адіабатним (адіабатичним) процесом називається термодинамічний процес, що відбувається в системі без теплообміну із зовнішніми тілами.
Стан системи можна описати за допомогою фізичних величин, які називаються функціями стану. Зміни функцій стану при термодинамічних процесах не залежать від виду цих процесів. Функції стану однозначно визначаються значеннями параметрів початкового й кінцевого станів системи. Найпростішими функціями стану системи є її внутрішня енергія U й ентропія S.
Найбільш простий вигляд має рівняння стану ідеального газу. Ідеальним газом називається газ, у якого енергія- потенційної взаємодії між молекулами настільки мала, що нею можна знехтувати, а самі молекули займають настільки малий об'єм порівняно з об'ємом газу, що його можна не брати до уваги. В ідеальному газі молекули взаємодіють тільки при зіткненнях. У реальних газів (сильно стиснутих газів) молекули зазнають сили міжмолекулярної взаємодії. Гази, що перебувають в умовах тисків, близьких до атмосферного, можна вважати ідеальними газами.
Для ідеального газу рівняння стану набуває форми, що дістала назву рівняння Менделєєва-Клапейрона:
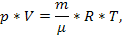 де
де 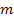 — маса газу ,
— маса газу , 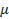 — молярна маса газу, R — універсальна газова стала (
— молярна маса газу, R — універсальна газова стала ( 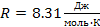 ).
).
Довільна термодинамічна система, що перебуває в якому завгодно термодинамічному стані, має повну енергію, що складається з кінетичної енергії механічного руху системи як цілого; потенційної енергії системи в зовнішніх силових полях (наприклад, електромагнітному, гравітаційному); внутрішньої енергії U.
Внутрішньою енергією термодинамічної системи називається енергія, яка залежить тільки від термодинамічного стану системи. Для нерухомої системи, що не зазнає дії зовнішніх силових полів, внутрішня енергія збігається з повною енергією. Внутрішня енергія містить у собі енергію усіх видів внутрішніх рухів у системі й енергію взаємодії всіх частинок (атомів, молекул, іонів і т.д.), що входять до системи.
Наприклад, внутрішня енергія газу багатоатомних молекул складається з: а) кінетичної енергії теплового поступального й обертального руху молекул; б) кінетичної і потенційної енергії коливань атомів у молекулах; в) потенційної енергії, зумовленої міжмолекулярними взаємодіями; г) енергії електронних оболонок атомів та іонів; д) кінетичної енергії і потенційної енергії взаємодії протонів і нейтронів у ядрах атомів.
Доданки г) і д) звичайно не змінюються в процесах, що відбуваються при не дуже високих температурах, коли іонізація і збудження не відіграють істотної ролі. У цих умовах доданки г) і д) не враховуються в балансі внутрішньої енергії. Для ідеального газу не враховується також доданок в).
Внутрішня енергія є однозначною функцією термодинамічного стану системи. Значення внутрішньої енергії в будь-якому стані не залежить від того, за допомогою якого процесу система досягла даного стану. Зміна внутрішньої енергії при переході системи зі стану 1 у стан 2 дорівнює
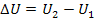 і не залежить від виду процесу переходу 1 -" 2. Якщо система перебуває у стані циклічного процесу, то повна зміна її внутрішньої енергії дорівнює нулю.
і не залежить від виду процесу переходу 1 -" 2. Якщо система перебуває у стані циклічного процесу, то повна зміна її внутрішньої енергії дорівнює нулю.
Вище зазначалося, що обмін енергією між термодинамічною системою і зовнішніми тілами відбувається двома шляхами: або в разі здійснення роботи, або шляхом теплообміну. Кількість енергії, яку зовнішні тіла передали системі при силовій взаємодії між ними, називається роботою А виконаною над системою. Кількість енергії, яку зовнішні тіла передали системі шляхом теплообміну, називається кількістю теплоти Q, наданої системі.
Обмін енергією між нерухомою системою і зовнішнім середовищем шляхом виконання роботи може відбуватися лише при зміні об'єму та форми системи. Коли ідеальному газу надається якась кількість теплоти, то газ може виконати роботу проти зовнішнього тиску.
Таким чином, збільшення внутрішньої енергії системи повинно дорівнювати сумі виконаної над системою роботи А' і кількості наданого системі тепла Q:
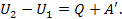 Звичайно замість роботи А', виконаної зовнішніми тілами над системою, розглядають роботу А (що дорівнює —
Звичайно замість роботи А', виконаної зовнішніми тілами над системою, розглядають роботу А (що дорівнює — 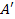 ), яку виконує система над зовнішніми тілами. Тоді
), яку виконує система над зовнішніми тілами. Тоді
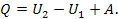 Це рівняння виражає закон збереження енергії і являє собою зміст першого закону (начала) термодинаміки. Словами його можна виразити в такий спосіб: тепло, що надається системі, витрачається на збільшення внутрішньої енергії системи і на виконання системою роботи над зовнішніми тілами.
Це рівняння виражає закон збереження енергії і являє собою зміст першого закону (начала) термодинаміки. Словами його можна виразити в такий спосіб: тепло, що надається системі, витрачається на збільшення внутрішньої енергії системи і на виконання системою роботи над зовнішніми тілами.
Розглянемо, як записується перший закон термодинаміки для різних процесів в ідеальному газі.
При ізотермічному процесі зміна температури не відбувається і, отже, внутрішня енергія системи не змінюється (AU = 0). Тоді перший закон термодинаміки має вигляд:
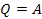 тобто все підведене тепло переходить у роботу газу над зовнішніми тілами.
тобто все підведене тепло переходить у роботу газу над зовнішніми тілами.
При ізохорному процесі об'єм газу не змінюється і тому роботу газ не виконує: 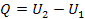
При ізобарному процесі відбувається збільшення внутрішньої енергії й виконується робота ( 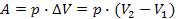 ):
):
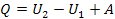 І, нарешті, в адіабатичному процесі Q = 0, тобто
І, нарешті, в адіабатичному процесі Q = 0, тобто
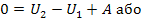

Можна дати ще одне формулювання першого закону термодинаміки: вічний двигун першого роду неможливий. Вічним двигуном першого роду називається така періодична працююча машина, яка виробляє роботи більше, ніж підведена до неї кількість теплоти..;
Таким чином, із вищерозглянутого можна сформулювати такі висновки. Енергія — єдина міра різних форм руху матерії.
Механічна енергія і теплова енергія — це тільки дві з багатьох форм енергії.
Можливі два якісно різних способи передачі енергії від одного макроскопічного тіла до іншого у формі роботи та у формі теплообміну. При цьому макроскопічне тіло розглядається як сукупність величезної кількості мікрочастинок. Зміну енергії тіла, здійснену першим способом, називають роботою, виконаною над цим тілом. Передача енергії у формі роботи здійснюється у процесі силової взаємодії тіл і завжди супроводжується макропереміщенням.
Передача енергії шляхом теплообміну між тілами зумовлена різницею температур цих тіл.
Неможливий вічний двигун першого роду. Це одне з формулювань першого закону термодинаміки.
Усіма явищами природи керує закон збереження енергії: енергія в природі не виникає з нічого і не зникає нікуди; кількість енергії незмінна, вона лише переходить з однієї форми в іншу.
Дата добавления: 2015-02-23; просмотров: 990;
