Определение ионного состава фильтрата
4.3.1. Качественное определение хлоридов (Cl-)
В фильтрате талой воды определяют наличие ионов Cl-, SO42-, Ca2+.
Хлорид-ионы определяют по методике, приведенной в разделе 2.3.1.
4.3.2. Качественное определение сульфатов (SO42-)
В пробирку наливают 3 мл талой воды, добавляют 3 – 4 капли 10%-ой соляной кислоты и 2 мл 20%-го раствора хлорида бария. Раствор в пробирке медленно нагревают до кипения. При наличии сульфатов протекает реакция:
Na2SO4 + BaCl2 = 2NaCl + BaSO4 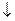
Сульфат бария выпадает в виде белого мелкокристаллического осадка практически нерастворимого в соляной и азотной кислотах. Образование ясно видимого белого осадка свидетельствует о содержании сульфатов в количестве нескольких десятых долей процента и более. Сильная муть указывает на содержание сульфатов в количестве сотых долей процента. Слабая муть заметная лишь на черном фоне, образуется при содержании сульфатов в количестве тысячных долей процента. Наличие ионов SO42- может быть связано с присутствием в фильтрате токсичных солей Na2SO4 и MgSO4.
4.3.3. Качественное определение кальция (Ca2+)
В пробирку наливают 5 мл талой воды, приливают 2 мл 4%-го раствора оксалата аммония, добавляют по каплям концентрированный раствор аммиака (NH4OH) и хлорида аммония до рН 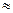 8 и нагревают до кипения. При наличии кальция протекает реакция:
8 и нагревают до кипения. При наличии кальция протекает реакция:
CaCl2 + (NH4)2C2O4 = 2NH4Cl + CaC2O4 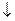
Выпадающий белый кристаллический осадок оксалата кальция свидетельствует о содержании кальция в количестве десятых долей и единиц процента. При содержании кальция в количестве сотых долей процента наблюдается не осадок, а легкое помутнение раствора. Наличие ионов Са2+ может быть связано с присутствием в фильтрате токсичной соли СaCl2 и нетоксичных солей Ca(NO3)2 и Ca(HCO3)2.
Дата добавления: 2015-02-23; просмотров: 1299;
