Определение электропроводности слабых электролитов
Проводники электрического тока делятся на проводники первого и второго рода. К проводникам первого рода относятся металлы и их сплавы, графит и другие материалы. Проводниками второго рода называют растворы кислот, щелочей и солей, расплавленные соли и кристаллы некоторых твердых солей.
Перенос электричества в проводниках первого рода осуществляется движением электронов по проводнику, в проводниках второго рода перенос электричества осуществляется движением ионов, и сила тока представляет собой суммарный результат движения катионов и анионов. Сопротивление, а, следовательно, и электропроводность зависит от длины и поперечного сечения проводника, а именно: 
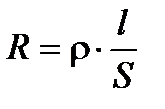 , где /1/
, где /1/
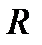 - сопротивление проводника (Ом);
- сопротивление проводника (Ом);
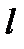 - длина проводника (см);
- длина проводника (см);
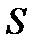 - площадь поперечного сечения (см2);
- площадь поперечного сечения (см2);
 - удельное сопротивление (Ом . см).
- удельное сопротивление (Ом . см).
Электропроводность – величина, обратная сопротивлению электрического тока, т.е.
 = æ
= æ 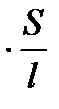 , /2/
, /2/
где æ – удельная электропроводность, æ = 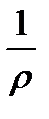 (Ом-1 .см-1);
(Ом-1 .см-1);
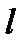 - длина проводника (см);
- длина проводника (см);
S – поперечное сечение проводника (см2).
Удельной электропроводностью называют электропроводность одного мл раствора, помещенного между электродами с поверхностью 1 см2, находящимися на расстоянии 1 см друг от друга.
Удельная электропроводность различных электролитов, сравниваемая при одинаковых условиях, температуре и концентрации, различна. Удельная электропроводность слабых электролитов с повышением концентрации растет незначительно. Уменьшение ее вызвано падением степени диссоциации. Удельная электропроводность с уменьшением концентрации падает, но не пропорционально, она убывает медленнее, чем разведение раствора. Только в очень разбавленных растворах солей, сильных кислот и оснований обе величины становятся пропорциональными.
Более наглядно выглядят эти закономерности, если пользоваться не удельной, а эквивалентной электропроводностью. Она зависит от свойств растворенного вещества, выражающихся в способности переносить в единицу времени большего или меньшего количества электричества. Способность различных электролитов проводить электрический ток удобно сравнивать в таких условиях, когда в слое жидкости, заключенном между электродами, находятся химически сравнимые количества различных веществ. Такими химически сравнимыми количествами являются грамм-эквивалент или грамм-моль вещества.
Эквивалентной электропроводностью называют электропроводность столба жидкости, заключенного между электродами, находящимися друг от друга на расстоянии 1 см при такой площади поверхности электродов, что между ними находится объем жидкости, содержащий 1 грамм-эквивалент вещества.
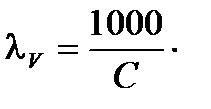 æ = 1000 . V . æ, [Ом-1 . см-1 . м-1], где /3/
æ = 1000 . V . æ, [Ом-1 . см-1 . м-1], где /3/
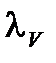 - эквивалентная электропроводность при данном разведении;
- эквивалентная электропроводность при данном разведении;
С – концентрация раствора;
 - разбавление раствора, т.е. величина, обратная концентрации (
- разбавление раствора, т.е. величина, обратная концентрации (  = 1 / С).
= 1 / С).
Эквивалентная электропроводность раствора повышается при его разбавлении благодаря тому, что количество электролита между электродами остается постоянным (грамм-эквивалент), а число ионов, образующихся при разбавлении, увеличивается.
Причем все ионы остаются между электродами, участвуя в переносе электричества. Следовательно, возрастание эквивалентной электропроводности раствора данного электролита при разбавлении определяется степенью электролитической диссоциации и вместе с ней, по мере разбавления, стремится к пределу, после которого остается постоянной. Это предельное значение электропроводности называется электропроводностью при бесконечном разведении и обозначается 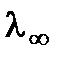 . Электропроводность при бесконечном разведении вычисляется как сумма подвижностей ионов (катионов -
. Электропроводность при бесконечном разведении вычисляется как сумма подвижностей ионов (катионов - 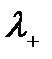 и анионов -
и анионов - 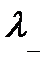 ):
): 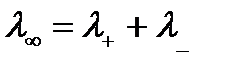
Определив эквивалентную электропроводность раствора и, зная подвижность ионов, можно вычислить степень диссоциации по формуле:
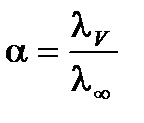 .
.
Степень диссоциации слабого электролита в водном растворе с разбавлением V определяется частным от деления значения эквивалентной электропроводности при этом разбавлении на значение электропроводности при бесконечном разведении.
В растворах слабых электролитов имеются недиссоциированные молекулы, а также катионы и анионы, образовавшиеся вследствие электролитической диссоциации некоторой части молекул. Между ними в растворе устанавливается динамическое (подвижное равновесие, характеризуемое при данной температуре и данной общей концентрации электролита постоянной величиной – константой электролитической диссоциации, которую можно вычислить на основании закона действующих масс. Для молекул, способных диссоциировать на два иона, КА Û К+ + А-:
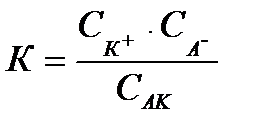 , где /4/
, где /4/
К – константа электролитической диссоциации;
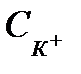 - концентрация катионов;
- концентрация катионов;
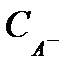 - концентрация анионов;
- концентрация анионов;
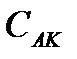 - концентрация недиссоциированных молекул.
- концентрация недиссоциированных молекул.
Если концентрацию электролита в объеме V принять равной С:
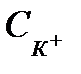 =
= 
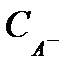 = a . С, тогда концентрация недиссоциированных молекул определяется по формуле:
= a . С, тогда концентрация недиссоциированных молекул определяется по формуле:
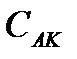 = (1 - a) . С , учитывая это, получим для константы диссоциации:
= (1 - a) . С , учитывая это, получим для константы диссоциации:
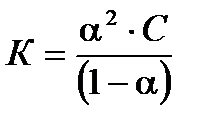 . /5/
. /5/
Учитывая, что V = 1/С, получим:
 . /6/
. /6/
Подставим значение степени диссоциации 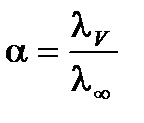 в /6/:
в /6/:
 =
= 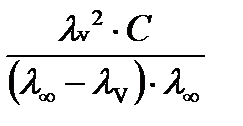 /7/
/7/
Последние два уравнения носят название закона разведения Оствальда. Целью данной работы является проверка настоящего закона.
Дата добавления: 2015-02-16; просмотров: 3001;
