Краткая теория. Химическая кинетика - учение о скоростях химических реакций
Химическая кинетика - учение о скоростях химических реакций. Скорость протекания химических реакций имеет громадное практическое значение, поэтому определение ее является важной задачей экспериментатора. Факты показывают, что скорость химической реакции зависит от многих причин, в частности, от концентрации веществ, температуры, катализатора, а также часто зависит от присутствия веществ, которые с первого взгляда не имеют никакого отношения к реакции.
К математическому выражению скорости реакции можно подойти следующим путем.
Пусть концентрация вещества А в какой-либо реакции в момент времени t0 равна C0, с ходом реакции эта концентрация уменьшается, и пусть к моменту времени t1 она равна C1. За промежуток времени t1-t0 произошло изменение концентрации C0-C1- (падение), тогда отношение 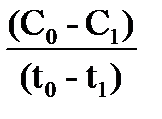 является средней скоростью реакции за данный промежуток времени. Если промежуток времени мал, то изменение концентрации также мало и равно DС, и соответственно средняя скорость равна:
является средней скоростью реакции за данный промежуток времени. Если промежуток времени мал, то изменение концентрации также мало и равно DС, и соответственно средняя скорость равна: 
Перейдя к пределу, в общем случае, получим: 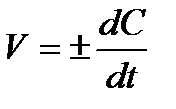 , где знак (+) – относится к изменению концентрации продуктов реакции, а знак (–) – к изменению концентрации исходных веществ. Это есть математическое выражение для истинной скорости реакции в данный момент времени: другими словами, истинная скорость реакции выражается производной от концентрации реагирующего вещества по времени.
, где знак (+) – относится к изменению концентрации продуктов реакции, а знак (–) – к изменению концентрации исходных веществ. Это есть математическое выражение для истинной скорости реакции в данный момент времени: другими словами, истинная скорость реакции выражается производной от концентрации реагирующего вещества по времени.
Основной постулат химической кинетики гласит:
истинная скорость химической реакции прямо пропорциональна произведению степенных функций от концентраций реагирующих веществ, т.е., например, для реакции:
а A + в B + ... ® n N + m M + ...
 ; (1 )
; (1 )
где К - коэффициент пропорциональности, a и b - степени, даваемые стехиометрическими коэффициентами аи в.
Реакции различаются молекулярностью и порядком.
Молекулярность реакцииопределяется количеством молекул, участвующих в элементарном акте химической реакции. Например, мономолекулярными реакциями называются те, в которых один только вид молекул претерпевает превращение.
Порядок реакцииопределяется суммой показателей степеней при концентрациях в уравнении основного постулата химической кинетики для данной реакции(n = a + b, где a и b - частные порядки реакции по веществу А и В соответственно).
Примером реакции первого порядка является реакция разложения перекиси водорода.
Если концентрация H2O2 в момент времени t равна C, то скорость разложения согласно постулату кинетики будет:
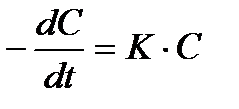 (2 )
(2 )
Пусть в объеме V в момент времени t0 = 0 находится а молей перекиси водорода, тогда начальная концентрация С0 = 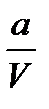 , и пусть за время t разложилось x молей перекиси водорода, значит к моменту времени t остается (а-x) молей перекиси. Тогда
, и пусть за время t разложилось x молей перекиси водорода, значит к моменту времени t остается (а-x) молей перекиси. Тогда  , откуда:
, откуда:  , а после некоторых преобразований получим
, а после некоторых преобразований получим 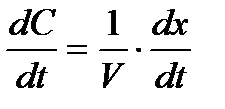 , и, подставив в формулу (2) найдем
, и, подставив в формулу (2) найдем 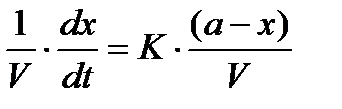 , разделяя переменные и проинтегрировав, получим:
, разделяя переменные и проинтегрировав, получим:
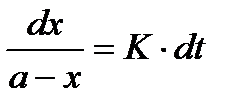 ; откуда
; откуда 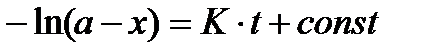 ,
,
так как в момент времени t = 0 x= 0 то const = - ln a, откуда имеем
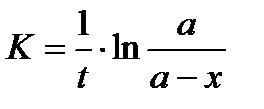 .
.
Учитывая тот факт, что константу скорости необходимо находить в любые промежутки времени, последнее уравнение можно переписать
 .
.
Переходя к десятичным логарифмам получим:
 (3)
(3)
где: а - объем, который мог занять кислород при полном разложении
перекиси водорода, взятой для опыта;
t - время в минутах;
x1- объем кислорода, выделившегося за время t1;
x2 - объем кислорода, выделившегося за время t2.
Величину а рассчитывают исходя из концентрации перекиси водорода по уравнению реакции:
2Н2О2 ® 2Н2О + О2 (4)
Если концентрация Н2О2 (например) равна 13,2 моль/л, это значит, что в 1000 мл раствора содержится 13,2 моль Н2О2. Так как мы использовали 0,3; 0,4 или 0,5 мл Н2О2, то необходимо рассчитать, сколько это составляет в молях.
Так как, из 2 моль Н2О2 по уравнению (4) выделяется 1 моль О2 (22,4×103 мл) [при н.у.], то необходимо рассчитать, сколько мл (V0, при н.у.) О2 выделится из использованного для реакции количества Н2О2 (0,3 или 0,5 мл). Затем, объем кислорода необходимо привести к реальным условиям: 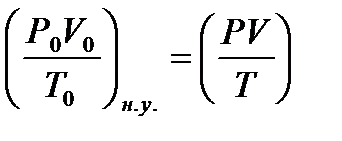 ,
,
где полученное значение V и будет соответствовать величине а.
Целью настоящей работы является проверка того факта, что реакция разложения перекиси водорода следует выше описанному закону.
Перекись водорода в чистом виде – это бесцветная жидкость, почти в 1,15 раза плотнее, чем вода. Она является сильным окислителем.
Кислород, который она выделяет, превращает сернистую кислоту в серную, фосфористую в фосфорную. Органические кислоты - щавелевая, молочная сгорают от перекиси. Но самый сильный окислитель оказывается очень сильным восстановителем.
Кислород, выделяющийся при разложении перекиси, находится в атомном состоянии. Устойчивая форма кислорода - молекулярная (из двух атомов). Поэтому каждый атом кислорода, образовавшийся при разложении перекиси, стремится найти себе пару, второй кислородный атом. Именно поэтому перекись и взаимодействует с окисью серебра, отбирая у нее кислород и восстанавливая металлическое серебро. Перекись водорода разлагается от действия многих веществ: серебра, золота, платины, окиси железа. По-разному она разлагается и в различных средах: интенсивно в щелочных, менее интенсивно - в кислых средах.
Реакция идет по схеме:
1. Pt + H2O2 = Pt* O+H2O
2. Pt* O+H2O2=Pt+H2O+O2,
где Pt*O- возбужденный оксид
Первая стадия заключается в образовании возбужденного оксида активной формы этой реакции. Если на этот возбужденный оксид вскоре попадает молекула перекиси, то реакция протекает по второй стадии, определяющей скорость реакции, но в активном возбужденном состоянии оксид платины находится непродолжительное время.
Если на него вскоре после образования не попадет молекула Н2О2 , то связь между кислородом и платиной упрочняется, что по существу может привести к своеобразному отравлению таких активных центров. Таким образом, в первое время на платине реакция разложения перекиси водорода в серной кислоте протекает с большой скоростью на чистой поверхности, благодаря образованию и распаду некоторых возбужденных оксидов. Но по мере протекания реакции накапливается количество малоактивных прочных оксидов платины и ее активность падает. Значительно активнее идет реакция в щелочной среде. Объяснить данное явление можно наличием большой концентрации гидроксильных ионов, которые, как известно, увеличивают скорость разложения перекиси водорода. Слабее реакция идет в H2SO4 и совсем слабо в HСl.Выполнение работы
Во избежание побочных факторов, влияющих на скорость разложения перекиси, в частности, явление диффузии, работу выполняют при интенсивном перемешивании на магнитной мешалке. Реакционный сосуд имеет следующий вид (рис.1):
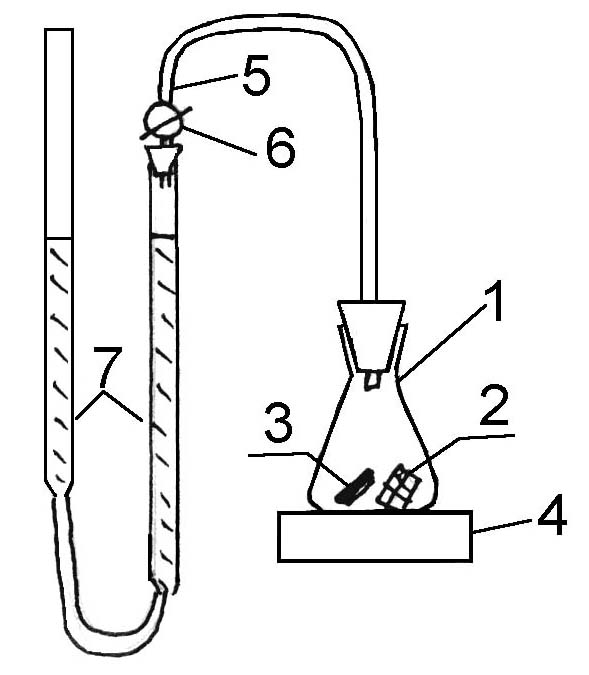
| Рис.1 1. Коническая колба 2. Платиновая сетка 3. Мешалка 4. Аппарат для перемешивания 5. Газоотводная трубка 6. Трехходовой кран 7. Две бюретки, соединенные резиновой трубкой |
Перед началом работы реакционный сосуд с помещенной в него платиновой сеткой, мешалкой и 25 мл рабочего раствора соединяют в соответствии с рисунком и проверяют на герметичность. Для этого приводят давление внутри системы к атмосферному, уровняв на произвольной высоте жидкость в бюретках, поворачивают кран (6) так, чтобы пространство над жидкостью в колбе (1) сообщалось с бюреткой (7) и одну из бюреток то поднимают, то опускают. Если обеспечена достаточная герметичность, уровень жидкости в другой бюретке не должен смещаться.
Проверив систему на герметичность, при кране, сообщающемся с атмосферой, внести в реакционных сосуд от 0,3 до 0,5 мл перекиси водорода (по заданию преподавателя), включить мешалку одновременно с секундомером. Через минуту перекрыть кран, впуская кислород в бюретку и проводить замеры выделившегося кислорода при разложении перекиси водорода через каждую минуту.
Для измерения истинного объема выделившегося кислорода вторую бюретку опускать относительно первой. Опыты проводить в строгой последовательности в рабочих растворах:
1. 15 мин. в 1н H2SO4.
2. 15 мин. в 1н KOH
3. 12 мин. в 1н HСl
Результаты во время опытов записывать в таблицу:
| Время, мин. | Объем кислорода, мл | ||
| в H2SO4 | в KOH | в HCl | |
| - -- |
Перед каждой сменой рабочего раствора реакционный сосуд вместе с платиновой сеткой тщательно промыть дистиллированной водой (сливать растворы в кристаллизатор).
Дата добавления: 2015-02-16; просмотров: 2145;
