ИВЛ при заболеваниях и поражениях мозга
Проведение респираторной поддержки у пациентов с заболеваниями и повреждениями мозга наиболее ярко демонстрирует изменение отношения к ИВЛ, которую более не рассматривают как протез, а считают методом лечения. Многочисленными исследованиями, включая наши собственные, доказано, что для оксигенации пораженного мозга недостаточно нормальных показателей напряжения кислорода в артериальной крови [Царенко С. В., 2005].
Согласно традиционным представлениям, транспорт кислорода в ткани осуществляется путем перемещения (конвекции). Следовательно, для обеспечения максимальной доставки кислорода к периферическим тканям необходимо поддержание насыщения гемоглобина кислородом на уровне 99- 100%. Такое насыщение обеспечивается при величине парциального напряжения кислорода в артериальной крови 80 -90 мм рт. ст. Дальнейшее возрастание этого показателя, согласно существующим представлениям, для увеличения транспорта кислорода ничего не дает.
Оставляя за рамками книги научную дискуссию о диффузионных механизмах транспорта кислорода и особенностях кровоснабжения мозга, отметим несомненный клинический факт: уровень бодрствования при поражениях и заболеваниях головного мозга прямо пропорционален величине раO2. Выраженность очаговой и дислокационной неврологической симптоматики часто обратно пропорциональна парциальному напряжению кислорода в артериальной крови. По нашим данным, минимально допустимый уровень этого показателя при коматозном состоянии составляет 150 мм рт. ст.
Указанные соображения приводят к следующей основной доктрине респираторной поддержки при черепно-мозговой травме (ЧМТ) и заболеваниях мозга:
"Показанием к ИВЛ является не только дыхательная недостаточность, но и признаки церебральной недостаточности".
Более практичной выглядит следующая формулировка:
"Всем больным, находящимся в сопоре и коме, должна быть произведена интубация трахеи и начата ИВЛ".
Для больных рассматриваемой категории, кроме обеспечения высокой оксигенации, очень важно поддержание нормального уровня углекислоты. Гиперкапния может вызывать повышенное кровенаполнение мозга и привести к нарастанию внутричерепной гипертензии. Гипокапния способствует спазму мозговых сосудов и нарастанию церебральной ишемии.
Кроме того, в острейшем периоде ЧМТ и заболеваний мозга следует быть очень внимательным к предупреждению резкого повышения внутри грудного давления. Значительное повышение этого показателя может вызывать нарушения кровотока в мозге. На указанной проблеме необходимо остановиться подробнее.
В норме и при патологии мозговой кровоток определяется притоком крови к мозгу и сопротивлением ему. Приток крови обеспечивается артериальным давлением. На сопротивление оттоку влияют два фактора: венозное и внутричерепное давление. При отсутствии поражения мозга уровень внутричерепного давление (ВЧД) достаточно низок - 0 - 15 мм рт. ст. (рис. 11.12). В связи с этим в норме основной фактор сопротивления оттоку - центральное венозное давление (ЦВД), которое прямо зависит от внутригрудного; последнее несколько затрудняет мозговой кровоток. Церебральное перфузионное давление (ЦПД) будет определяться разницей системного артериального давления (АД) и ЦВД. Указанная ситуация не имеет существенного клинического значения, поскольку при непораженном мозге нет сверхнормативных требований к обеспечению церебрального кровотока.
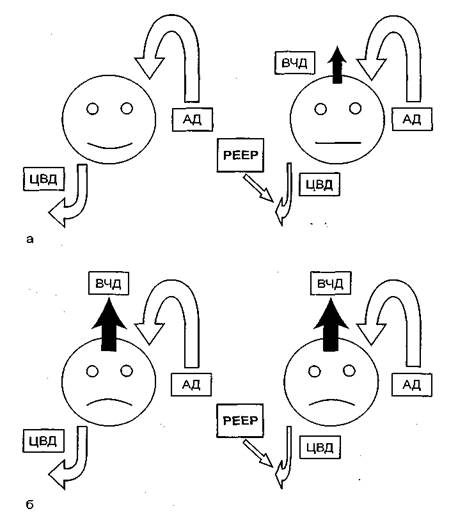
Рис. 11.12. Влияние PEEP на мозговой кровоток. а - использование PEEP ухудшает мозговой кровоток только при нормальном внутричерепном давлении (ЦПД = АД - ЦВД); б - при внутричерепной гипертензии PEEP не влияет на мозговой кровоток: отток крови из мозга зависит от ВЧД - резистор Стерлинга (ЦПД = АД - ВЧД).
При поражении мозга ВЧД повышается до 30 мм рт. ст. и более. В этом случае сопротивление притоку крови определяется именно этим фактором, а не венозным давлением. В физиологии описываемая ситуация носит название резистора Старлинга. Церебральное перфузионное давление будет определяться разницей системного АД и ВЧД. Исходя из этого, колебания внутригрудного давления только тогда будут влиять на мозговой кровоток, когда их абсолютная величина превысит уровень ВЧД. Очевидно, что затруднения для мозгового кровотока возникнут при значительных подъемах внутригрудного давления во время кашля, на высоте рекрутмент-маневра, при выполнении фибробронхоскопии. Таким образом, бытующие представления об опасности любого режима ИВЛ и высокого PEEP для кровообращения пораженного мозга не имеют под собой серьезных физиологических оснований.
Необходимо отметить еще одно важное обстоятельство. У пациентов с угнетением сознания развиваются псевдобульбарные расстройства с нарушением тонуса мышц языка и ротоглотки. Кроме того, страдает координация мышц, участвующих в акте глотания. В результате описанных процессов высока вероятность макро- и микроаспирации содержимого ротоглотки с развитием воспалительных процессов в легких. Радикальным средством решения данной проблемы служит ранняя интубация трахеи с последующей трахеостомией. Особенно хорошо зарекомендовали себя специальные интубационные и трахеостомические трубки с возможностью надманжеточной аспирации стекающего в трахею содержимого ротоглотки (рис. 11.13).
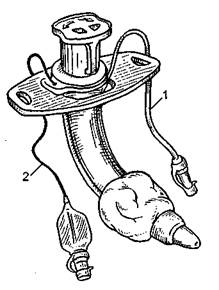
Рис. 11.13. Трубка с каналом для надманжеточной аспирации. 1-канал для аспирации; 2 -канал для надувания манжеты.
Для надежного обеспечения оксигенации и вентиляции оптимальным методом респираторной поддержки при заболеваниях и повреждениях мозга является режим Volume Control в алгоритме Assist Control.
Примерные установки респиратора в режиме Volume Control: дыхательный объем 8-9 мл/кг (обычно 600 -700 мл), частота вдохов 12- 14 в 1 мин, PEEP - 5-8 см вод. ст., чувствительность - 3-4 см вод. ст., или 1,5-2 л/мин, форма потока - нисходящая, пауза вдоха - 0,1- 0,3 с, скорость пикового потока - 35-40 л/мин. Отношение вдоха к выдоху- 1: 2. У пациентов с затруднением выдоха скорость потока может быть увеличена до 70 -90 л/мин, отношение вдоха к выдоху уменьшено до 1:3 - 1:4, а величина паузы вдоха равняется нулю.
Величину FiO2 выбирают в соответствии с состоянием головного мозга: чем глубже коматозное состояние, тем выше концентрация кислорода. Как правило, используют величины 0,4- 0,6.
Лучше уровень FiO2 подбирать под контролем насыщения гемоглобина кислородом в венозной крови мозга. Осуществление указанного контроля возможно с помощью неинвазивной методики церебральной оксиметрии. Эффективным способом является также ретроградная катетеризация яремной вены и инвазивная оценка сатурации гемоглобина. Указанные величины должны составлять 65-75%.
Тревоги: Pmax - 20 -25 см вод. ст. Величина остальных устанавливается таким образом, чтобы отличаться на 15-20% от реальных показателей минутного и дыхательного объема, частоты дыхания, давления в дыхательных путях и PEEP.
Дата добавления: 2015-02-13; просмотров: 1031;
