ОСНОВЫ ЭЛЕКТРОХИМИИ
ТЕМА 7.1 СТАНДАРТНЫЙ ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
Электрохимия- область химии, изучающая процессы, которые либо сопровождаются возникновением электрического тока, либо вызваны электрическим током.
Электрохимические процессы относятся к окислительно-восстановительным. В окислительно-восстановительных реакциях электроны непосредственно переходят от восстановителя к окислителю. Если же процессы окисления и восстановления пространственно разделить, а электроны направить по металлическому проводнику, то такая система будет представлять собой гальванический элемент.
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов.
Выясним, что такое электродный потенциал. Представим себе, что пластинка какого-нибудь металла опущена в воду. В металле существует подвижное равновесие, которое можно.выразить уравнением
Ме↔Меn+ + nе,
где Me - атом металла; Меn+ - ион металла в электроде; n - заряд иона; е -электрон.
При погружении металла в воду ионы его поверхностного слоя под действием полярных молекул воды отрываются и гидратированными переходят в жидкость. В результате такого перехода жидкость заряжается положительно, а металл - отрицательно, так как на нем появляется избыток электронов. По мере перехода ионов металла в водную среду увеличивается как отрицательный заряд металла, так и положительный заряд раствора, при это все чаще и чаще ионы металла притягиваются обратно на металлическую пластинку. Накопление ионов металла в растворе начинает тормозить дальнейшее растворение металла. В результате устанавливается подвижное равновесие, которое можно представить в виде
Me + mH2O ↔ Men+ mН2О + nе.
Состояние равновесия зависит как от активности металла, так и от концентрации его ионов в растворе.
В случае активных металлов (Zn, Fe, Cd, Ni) взаимодействие с полярными молекулами воды оканчивается отрывом от поверхности положительных ионов металлов и переходом гидратированных ионов в раствор. Этот процесс является окислением. По мере увеличения концентрации катионов у поверхности становится вероятным обратный процесс - восстановлением ионов металла.
Электростатическое притяжение между катионами в растворе и избыточными электронами на поверхности образует двойной электрический слой.Это приводит к возникновению на границе соприкосновения металла и жидкости определенной разности потенциалов или скачка потенциала. Разность потенциалов, возникающую между металлом и окружающей его водной средой, называют электродным потенциалом.
Таким образом, при погружении металла в воду или в раствор, содержащий ионы данного металла, на поверхности раздела металл-раствор образуется двойной электрический слой и возникает разность потенциалов между металлом и раствором.
Потенциал каждого электрода зависит от природы металла, концентрации его ионов в растворе и температуры.
Если электродный потенциал измерен при стандартных условиях
(Т=298К и Р=105Па), то он называется стандартным относительным
электродным потенциалом.
Зависимость электродного потенциала от концентраций веществ, участвующих в электродных процессах, и от температуры, выражается уравнением Нернста

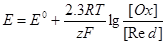 или
или 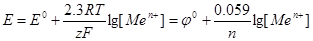
где Е° - стандартный электродный потенциал; R - газоваяпостоянная; Т -
абсолютная температура; F - постоянная Фарадея, F=96500Кл/моль; z- число
электронов, участвующих в электродном процессе; [Ох] и [Red] - произведения
концентраций веществ, принимающих участие в соответствующей полуреакции
в окисленной (Ох) и восстановленной (Red) формах; [Меn+] - концентрация
ионов металла в растворе; n - заряд Иона металла.
Например, для электродного процесса
Fe3+ +e = Fe2+
имеем: z=l,[Ox]=[Fe3+],[Red]=[Fe2+].
При осуществлении процесса в стандартных условиях концентрация каждого вещества, участвующего в реакции, равна единице, так что уравнение Нернста принимает вид
Е = Е°.
Таким образом, стандартным электродным потенциалом называется потенциал данного электрода при концентрациях всех веществ, участвующих в электродном процессе, равных единице.
ТЕМА 7.2 ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
Различие в величинах электродных потенциалов у разных металлических электродов позволяет создать гальванический элемент - систему, в которой энергия химических реакций превращается в электрическую энергию.
Дата добавления: 2015-02-10; просмотров: 874;
