Трансмембранная передача гормонального сигнала
Клеточные мембраны благодаря наличию специальных рецепторов воспринимают сигналы из внешней среды (например, молекулы гормонов, называемые первичными мессенджерами, или посредниками). Первый этап действия гормона на клетку-мишень - его присоединение к рецептору, далее сигнал передается внутрь клетки. По своей химической природе рецепторы почти всех биологически активных веществ являются гликопротеинами. Общее свойство рецепторов - высокая специфичность по отношению к одному определенному гормону.
Наиболее изученной является аденилатциклазная мессенджерная система(рис. 29).В нее входят рецептор гормона, G-белок, фермент аденилатциклаза, цАМФ-зависимая протеинкиназа, фосфодиэстераза.
Рецепторы гидрофильных гормонов, таких как адреналин, расположены на мембране. Связывание гормона (первичного мессенджера) с рецептором приводит к структурным изменениям внутриклеточного домена рецептора, что обеспечивает взаимодействие рецептора с ГТФ-связывающим белком (G-белком). G-белок представляет собой смесь 2 типов белков: активного Gs (от англ. stimulatory) и ингибиторного Gi. В составе каждого из них имеется три субъединицы (α, β и γ). Функция G-белка - проведение гормонального сигнала на уровне плазматической мембраны. В состоянии покоя G-белок связан с ГДФ. Гормонрецепторный комплекс переводит Gs-белок в активированное состояние, ГДФ замещается на ГТФ, что приводит к отделению субъединицы α, которая активирует аденилатциклазу.В отсутствие G-белка аденилатциклаза практически неактивна.
Аденилатциклаза- интегральный белок плазматических мембран, его активный центр ориентирован в сторону цитоплазмы. Аденилатциклаза катализирует реакцию синтеза из АТФ цАМФ(вторичного мессенджера).
Протеинкиназа А катализирует фосфорилирование внутриклеточных ферментов или белков-мишеней, изменяя их активность. Неактивная протеинкиназа А состоит из 4 субъединиц. Под действием цАМФ она переходит в активную форму за счет диссоциации субъединиц и фосфорилирует белок за счет АТФ. Процесс фосфорилирования-дефосфорилирования белков при участии протеинкиназ является общим фундаментальным механизмом действия вторичных мессенджеров внутри клетки.
Фосфодиэстераза вызывает распад цАМФ и тем самым прекращает действие сигнала.
| |
| Рис. 29. Аденилатциклазная мессенджерная система |
Инозитолфосфатная система(рис. 30)включает три основных мембранных белка: рецептор гормона, фосфолипазу С и белок Gplc, активирующий фосфолипазу.
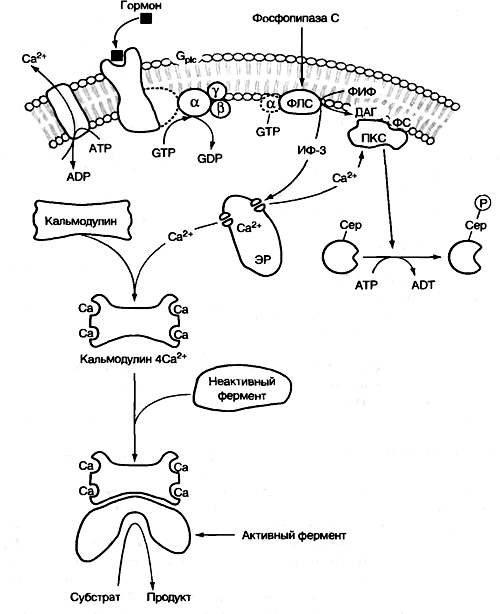
Рис. 30. Инозитолфосфатная мессенджерная система
Связывание гормона с рецептором приводит к изменению его конформации и увеличению сродства с белком Gplc. Он представляет собой тример, состоящий из субъединиц α, β и γ. При участии ГТФ комплекс «гормон - рецептор – G-белок» диссоциирует с освобождением a-субъединицы. Она взаимодействует с фосфолипазой С и активирует ее. Субстрат этого фермента – фосфатидилинозитол-4,5-бисфосфат (ФИФ). В инозитолфосфатной системе в роли вторичных мессенджеров участвуют инозитол-1,4,5-трисфосфат (ИФ-3), диацилглицерин (ДАГ) и ионы Са2+. ИФ-3 выходит в цитозоль. ДАГ остается в мембране и участвует в активации фермента протеинкиназы С. ИФ-3 связывается с кальциевым каналом мембраны ЭПР, канал открывается, и ионы Са2+ поступают в цитозоль. Увеличивается скорость взаимодействия ионов Са2+ с неактивной протеинкиназой С и белкомкальмодулином.
На внутренней стороне мебраны образуется комплекс «протеинкиназа С - Са2+ - ДАГ – фосфолипаза С». Происходит активирование протеинкиназы С, которая фосфорилирует ферменты по остаткам серина и треонина, меняя их активность.
Кальмодулин имеет 4 центра для связывания Са2+. Взаимодействие комплекса «кальмодулин - Са2+» с ферментами приводит к их активации.
Аденилатциклазная и инозитолфосфатная системы регулируют большое количество разных клеточных процессов. Эффект этих систем проявляется очень быстро.
Стероидные и тиреоидные гормоны обладают липофильными свойствами и легко проходят через клеточные мембраны. Их рецепторы находятся в цитозоле или в ядре клетки (внутриклеточные рецепторы).
Если рецептор гормона находится в цитозоле, там же происходит образование комплекса гормона с рецептором, который затем поступает в ядро. Рецепторы ряда гормонов расположены в ядре клетки, тогда комплекс «гормон – рецептор» может образоваться непосредственно в ядре (рис. 31).

|
| Рис. 31. Передача гормональных сигналов через внутриклеточные рецепторы |
В ядре комплекс гормон-рецептор взаимодействует с регуляторной нуклеотидной последовательностью ДНК, что приводит к изменению скорости транскрипции структурных генов и, следовательно, скорости трансляции. В результате изменяется количество белков, которые участвуют в метаболизме и влияют на функциональное состояние клетки.
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуются часы.
Гормоны обеспечивают коммуникацию (обмен информацией) между разными клетками и органами. В результате действия этих механизмов достигается координация метаболизма и функций разных клеток и органов и адекватная реакция организма на изменения внешней среды.
В роли внеклеточных сигналов могут действовать не только гормоны, но и ряд других веществ - цитокины, биогенные амины, нейромедиаторы и др.
Контрольные вопросы
1. Как классифицируют гормоны по их химической природе? Приведите примеры гормонов каждого из классов.
2. Каким образом гормоны могут влиять на протекание химических процессов в клетке?
3. Что понимают под первичными и вторичными мессенджерами?
4. Охарактеризуйте основные компоненты и механизм действия аденилатциклазной мессенджерной системы.
5. Какие белки являются компонентами аденилатциклазной мессенджерной системы?
6. Какие соединения являются вторичными мессенджерами в инозитолфосфатной системе?
7. Дайте сравнительную характеристику аденилатциклазной и инозитолфосфатной мессенджерной системам.
8. Каков механизм дейcтвия липофильных гормонов на процессы, протекающие внутри клетки?
9. Каким образом прекращается передача гормонального сигнала в клетку?
10. Какие химические соединения, кроме гормонов, могут участвовать в регуляции обменных процессов в клетках?
Дата добавления: 2015-02-10; просмотров: 11263;
