КЛАССИФИКАЦИЯ И НОМЕНКЛАТУРА ФЕРМЕНТОВ
Современные классификация и номенклатура ферментов разработаны Комиссией по ферментам Международного биохимического союза и утверждены на V Международном биохимическом конгрессе в 1961 г. в г. Москве.
В основу классификации легли три принципа:
1. Химическая природа фермента.
2. Химическая природа субстрата, на который действует фермент.
3. Тип катализируемой реакции.
Существует шесть классов ферментов.
| СООН СООН ½ ½ НО – С – Н малатдегидрогеназа С = О ½ + НАД+ ----------------------------à ½ + НАДН + Н+ Н – С – Н ß--------------------------- СН2 ½ ½ СООН СООН L – малат оксалоацетат |
Аэробные дегидрогеназы, или оксидазы, катализируют перенос протонов (электронов) непосредственно на кислород;
Анаэробные дегидрогеназы ускоряют перенос протонов (электронов) на промежуточный субстрат, но не на кислород.
Наиболее распространены оксидоредуктазы, содержащие в качестве кофактора никотинамидадениндинуклеотид (НАД+), либо никотинамидадениндинуклеотидфосфат(НАДФ+). Их называют пиридинферментами.
Коферментами оксидоредуктаз являются также флавопротеины (ФП) – флавинмононуклеотид (ФМН) и флавинадениндинуклеотид (ФАД). Подобные ферменты получили название флавиновых дегидрогеназ.
2. Трансферазы - ферменты, катализирующие реакции межмолекулярного переноса различных атомов, групп атомов и радикалов.
Фосфотрансферазыкатализируютперенос остатка фосфорной кислоты. Донором фосфатных остатков в большинстве случаев является АТФ. Фосфорные эфиры органических соединений обладают повышенной химической активностью. Реакция фосфорилирования глюкозы катализируется гексокиназой или АТФ,D-глюкоза-6-фосфотрансеразой:
Протеинкиназыпереносят остаток фосфата с АТФ на белки,изменяя их биологическую активность.
Аминотрансферазыускоряют реакцию переноса аминогруппы с аминокислоты на a-кетокислоту:
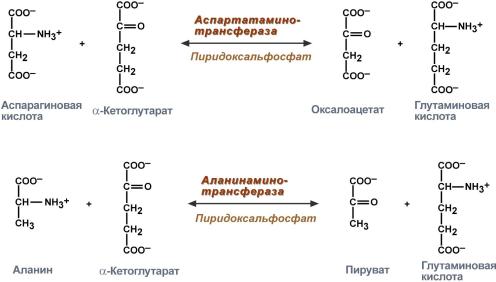
аспарагиновая α-кетоглутарат оксалоацетат глутаминовая
кислота кислота
Гликозилтрансферазыкатализируют реакции переноса гликозильных остатков; ацилтрансферазы– реакции переноса ацилов (остатков карбоновых кислот).
3. Гидролазыкатализируют расщепление внутримолекулярных связей органических веществ при участии молекулы воды.
| СН2 – О – СО – С15Н31 СН2 – ОН ½ липаза ½ СН – О – СО – С15Н31 + 2НОН ---------à СН – О – СО – С15Н31 + 2С15Н31СООН ½ ß-------- ½ пальмитиновая СН2 – О – СО – С15Н31 СН2 – ОН кислота трипальмитин b-пальмитилглицерин |
Фосфатазыгидролизуют фосфорные эфиры:
Г-1-Ф + Н2О 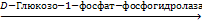 Г + Н3РО4
Г + Н3РО4
Гликозидазыкатализируют гидролиз гликозидов. Амилаза расщепляет гликозидные связи в молекулах крахмала.
Пептидгидролазыускоряют гидролиз пептидных связей в белках и пептидах.
4. Лиазы- ферменты, катализирующие разрыв связей С—О, С—С,
С—N и других, а также обратимые реакции отщепления различных групп от субстратов негидролитическим путем. Эти реакции, как правило, сопровождаются образованием двойной связи и выделением таких простейших продуктов, как СО2, H2O, NH3 и т. д..
Декарбоксилазы относятся к углерод-углерод-лиазам:
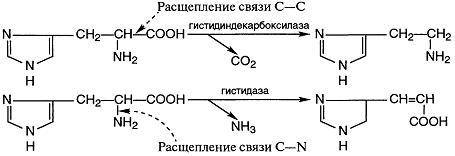
Некоторые лиазы ускоряют реакции не только отщепления, но и присоединения.
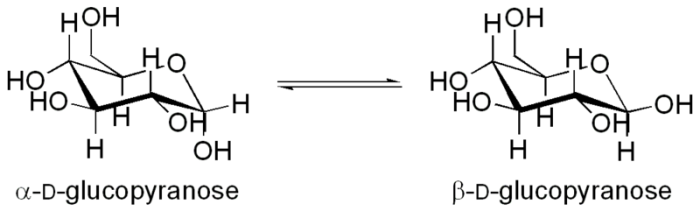
5. Изомеразы- ферменты, катализирующие взаимопревращения структурных, оптических и геометрических изомеров.
Мутаротазаускоряет реакцию превращения α-D-глюкопиранозы в
β-D-глюкопиранозу:
6. Лигазы (синтетазы) - ферменты, катализирующие синтез органических веществ из двух исходных молекул с использованием энергии АТФ либо других веществ:
пируваткарбоксилаза
СН3-СО-СООН + СО2 + АТФ ----------------------------àНООС-СН2-СО-СООН + АДФ + Рi.
пировиноградная оксалоацетат
кислота
Международная комиссия подготовила Классификацию ферментов (КФ).Код каждого фермента содержит четыре цифры, разделенные точками. Первая цифра указывает номер класса, вторая означает подкласс и характеризует вид субстрата (у трансфераз указывает на природу переносимой группы, у гидролаз - на тип гидролизуемой связи). Третья цифра уточняет природу участвующих в реакции соединений или групп. Четвертая цифра – номер фермента в данном подподклассе. В подподклассе ферменты располагаются по алфавиту. Пример: каталаза – 1.11.1.6.
Дата добавления: 2015-02-10; просмотров: 1469;
