Методы определения С-концевой аминокислоты
Ферментативные методы. Обработка белка карбоксипептидазой приводит к отщеплению С-концевой аминокислоты, которую определяют методом хроматографии.
Химический метод Акабори. Гидразин расщепляет пептидные связи и реагирует со всеми аминокислотами, за исключением С-концевой.
Следующим этапом является определение последовательности аминокислот в полипептидной цепи. Проводят частичный гидролиз полипептидной цепи; в результате образуются короткие пептиды. Избирательно гидролизующие вещества: цианогенбромид CNBr (по остаткам мет), гидроксиламин (по связям между остатками асп и гли), N-бромсукцинамид (по остаткам три). Пепсин ускоряет гидролиз пептидных связей, образованных фен, тир и глу, трипсин - арг и лиз, химотрипсин - три, тир и фен.
Используют также рентгеноструктурный анализ, а также данные о нуклеотидной последовательности ДНК (ДНК кодирует последовательность аминокислот в белке).
Вторичная структура белка – конфигурация полипептидной цепи, т.е. способ укладки полипептидной цепи в определенную конформацию
(рис. 1). Процесс этот протекает не беспорядочно, а в соответствии с первичной структурой белка.
 а
а
|  б
б
|
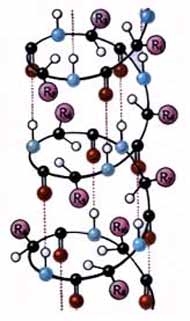
| Рис. 1. Вторичная структура белка: а - a-спираль, б - b-структура |
Вторичная структура поддерживается в основном водородными связями, хотя для некоторых белков определенный вклад вносят пептидные и дисульфидные ковалентные связи.
Наиболее вероятным типом вторичной структуры глобулярных белков является a-спираль. Закручивание полипептидной цепи в спираль происходит по часовой стрелке. Для каждого белка характерна определенная степень спирализации. Так, полипептидные цепи гемоглобина спирализованы на 75%, а молекула пепсина - на 30%.
Тип конфигурации полипептидных цепей, когда сегменты пептидной цепи располагаются в один слой, образуя структуру, подобную листу, сложенному в гармошку, называется b-структурой. Такой тип вторичной структуры обнаружен в белках мышц, волос, шелка. b-Слой может быть внутримолекулярным, а также образованным двумя или более полипептидными цепями.
Способность к образованию водородных связей, являющихся движущей силой при возникновении α- и β-структур в белковой молекуле, выражена у разных аминокислот в неодинаковой степени. Выделяют группу спиралеобразующих аминокислот: ала, глн, глу, лей, мет, лиз, гис. Вал, иле, тир, тре, фен способствуют образованию b-структур полипептидной цепи. Наличие сер, гли, про, асн, асп приводит к преимущественному образованию неупорядоченных фрагментов в белковой молекуле.
В природе существуют белки, строение которых не соответствует ни
β-, ни a-структуре (коллаген).
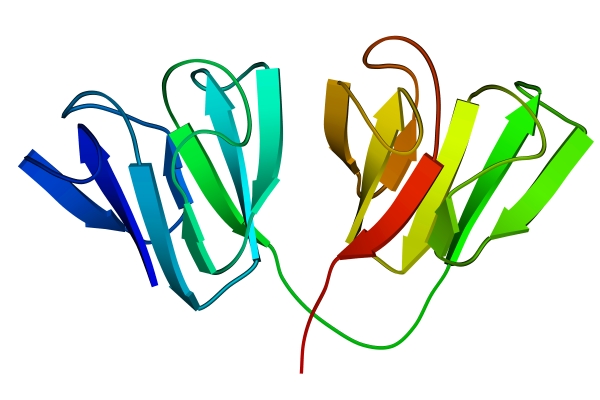
Третичная структура белка – пространственная ориентация полипептидной спирали или способ укладки полипептидной цепи в определенном объеме. Первый белок, Третичная структура белка (миоглобин кашалота) впервые была установлена методом рентгеноструктурного анализа (рис. 2).
В стабилизации пространственной структуры белков, помимо ковалентных связей, основная роль принадлежит нековалентным связям (межмолекулярные ван-дер-ваальсовы силы, водородные связи, электростатические взаимодействия ионизированных групп, гидрофобные взаимодействия и т.д.).
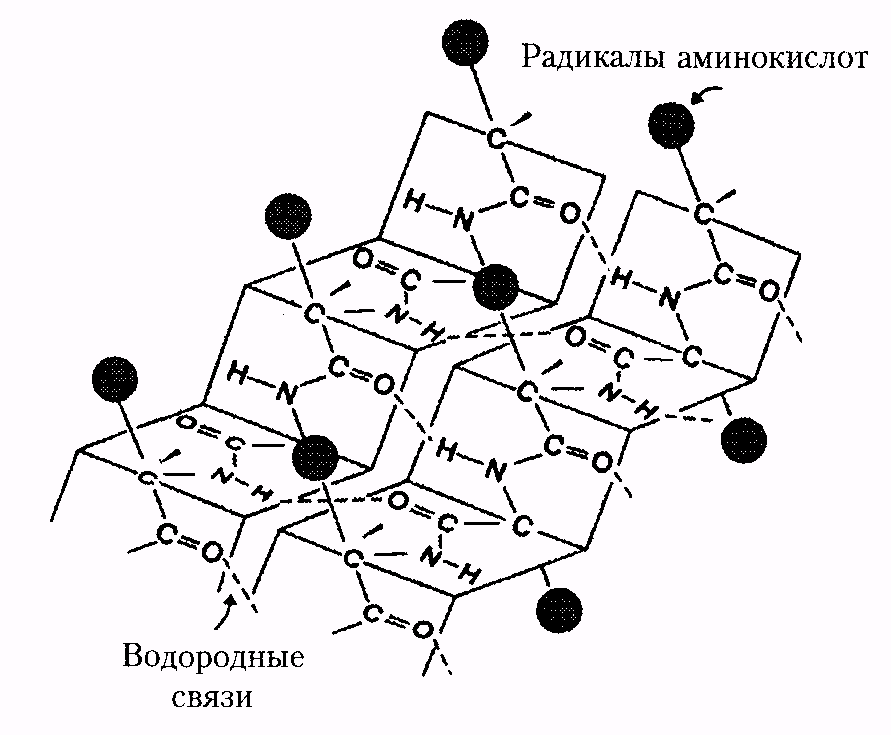
Методом рентгеноструктурного анализа установлено существование специфических уровней структурной организации белковой молекулы, промежуточных между вторичной и третичной структурами. Домен - это компактная глобулярная структурная единица внутри полипептидной цепи (рис. 3). Открыты белки (в частности, иммуноглобулины), в которых существуют различные по структуре и функциям домены.

| 
|
| Рис. 2. Третичная структура миоглобина | Рис. 3. Глобулярные домены в белке хрусталика глаза человека g-кристаллине |
Согласно современным представлениям, белка после окончания синтеза белка его третичная структура формируется самопроизвольно. Процесс формирования нативной пространственной структуры полипептидной цепи - фолдинг. Основной движущей силой фолдинга является взаимодействие радикалов аминокислот с молекулами воды. При этом гидрофобные радикалы аминокислот ориентируются внутрь белковой молекулы, а гидрофильные радикалы повернуты в сторону воды.
В клетках существуют белки, названные шаперонами. Их основная функция - участие в фолдинге (рис. 4). Описан ряд заболеваний человека, имеющих наследственную природу, возникновение которых связывают с нарушением процесса фолдинга вследствие мутаций (пигментозы, фиброзы и др.).
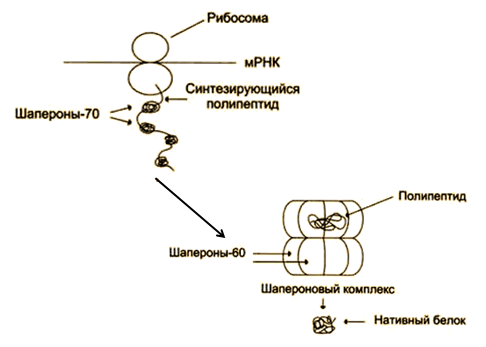
Рис. 4. Участие шаперонов в фолдинге белков
Все биологические свойства белков связаны с образованием и сохранностью третичной структуры, называемой нативной. Белковая глобула не является абсолютно жесткой структурой: возможны обратимые перемещения фрагментов полипептидной цепи. Эти изменения не приводят к нарушению общей конформации молекулы. Факторы, влияющие на конформацию белковой молекулы - ионная сила раствора, рН среды, взаимодействие с компонентами раствора. Любые воздействия, приводящие к нарушению нативной структуры молекулы, приводят к частичной или полной утрате белком его биологических свойств.
Четвертичная структура белка - укладка отдельных полипептидных цепей, обладающих специфической первичной, вторичной или третичной структурой, в пространстве, и формирование единого макромолекулярного образования.
Белок, состоящий из нескольких полипептидных цепей, называют олигомером, а каждую входящую в него полипептидную цепь - протомером. Олигомерные белки, как правило, состоят из четного числа псубъединиц, например, молекула гемоглобина построена из двух a- и двух b-полипептидных цепей (рис. 5).
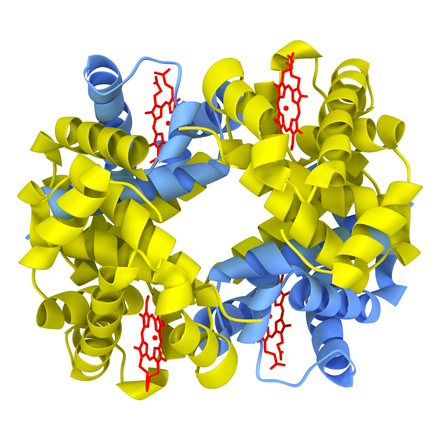
|
| Рис. 5. Молекула гемоглобина |
Четвертичную структуру имеют около 5% белков, такие как ферритин, иммуноглобулины. Субъединичное строение свойственно многим ферментам, в первую очередь тем, которые выполняют сложные функции. Почти все ДНК- и РНК-полимеразы имеют четвертичную структуру. Полипептидные цепи, входящие в состав белка с четвертичной структурой, образуются на рибосомах по отдельности. Только после завершения синтеза происходит их объединение в надмолекулярную структуру. Биологическую активность белок приобретает на уровне четвертичной структуры. Стабилизация четвертичной структуры происходит при участии тех же связей, что и при формировании третичной структуры, за исключением ковалентных связей.
Ряд исследователей признают наличие пятого уровня структурной организации белков. Полифункциональные макромолекулярные комплексы разных ферментов, катализирующие весь путь превращений субстрата, получили назвение метаболонов (пируватдегидрогеназный комплекс, синтетазы ВЖК, дыхательная цепь).
Белок, выполняющий специфическую функцию в метаболизме клетки, может быть представлен несколькими формами - изофункциональными белками, или изобелками. В эритроцитах крови человека обнаружено несколько форм гемоглобина: У взрослого человека преобладающей формой является НbА. Ч Для эмбриональной стадии развития человека характерен фетальный гемоглобин HbF. Все формы гемоглобинов выполняют функцию переноса кислорода из легких в ткани, однако свойства разных гемоглобинов отличаются.
Дата добавления: 2015-02-10; просмотров: 2166;
