Тема 2. «Чудеса!» Железные конструкции не ржавеют, а пористые металлические покрытия приводят к их ускоренному разрушению
До настоящего времени сознание неспециалистов по коррозии будоражит проблема индийской железной колонны – одной из многочисленных достопримечательностей индийской столицы, которая не ржавеет в атмосфере в течение нескольких сот лет.
Вот что пишет в своей книге «Открытие Индии» Джахарлал Неру: «Древняя Индия добилась, очевидно, больших успехов в обработке железа. Близ Дели высится огромная колонна, ставящая в тупик современных ученых, которые не могут определить способ ее изготовления, предохраняющий железо от окисления и других атмосферных явлений».
Колонна была воздвигнута в 415 году в часть царя Чандрагуты II. Первоначально ее установили на востоке страны перед одним из храмов, а в 1050 году царь Анант Пола перевез ее в Дели. По народному поверью, у того, кто прислонится к колонне спиной и сведет за ней руки, исполнится заветное желание. С давних времен стекались к ней толпы народа, желавших получить свою толику счастья.
Весит колонна 6,5 тонн. Ее высота – 7,3 м, диаметр – от 42 см у основания и до 30 см у верха. Изготовлена она почти из чистого железа (99,72 %), чем и объясняют ее долголетие. Многие утверждают, что любое, менее чистое железо, несомненно, превратилось бы за прошедшие 15 столетий в труху.
Некоторые писатели-фантасты не исключают, что она создана на другой планете, а завез ее к нам экипаж космического звездолета, который захватил ее с собой в качестве вымпела, либо как дар жителям Земли. По другим версиям колонна выкована из крупного железного метеорита.
Известный писатель С.И. Венецкий считает: «И все же, пожалуй, правы те ученые, которые объясняют этот факт высоким искусством древнеиндийских металлургов. Индия в те времена славилась на весь мир своими стальными изделиями, и не случайно у персов бытовала поговорка: «В Индию сталь возить», которая по смыслу аналогична русской поговорке: «Ехать в Тулу со своим самоваром».
К сожалению чудес не бывает. Английский ученый-коррозиолог Ю.Эванс взял пробу из колонны и отправил ее в Англию для исследования. По дороге в Англию кусочек этого чуда-железа покрылся ржавчиной. Был сделан вывод о том, что эта железная колонна не ржавеет именно в этом месте Индии. Она хорошо обдувается ветрами и влажной практически не бывает. Нет электролита – отсутствует электрохимическая коррозия металла. Необходимо отметить, что у основания колонны, где скапливается влага, она проржавела на 5 см в глубину. Пора думать о защитном покрытии, которое необходимо нанести на основание колонны, чтобы она радовала человечество еще много веков.
Подтверждением последнего является следующее. Образцом технического гения считается выбор магниевого сплава для изготовления колес пушек армии Роммеля, которая воевала в Северной Африке во время Второй мировой войны. Легкие магниевые колеса намного уменьшили вес пушек. Она могли не «ржаветь», т.к. их использовали в Сахаре. Бросьте магний в воду, а еще для более быстрого эффекта посолите воду, и вы увидите как начинает бурно выделяться водород, т.к. магний очень неблагородный металл (т.е. имеет очень отрицательный электродный потенциал). Через несколько часов от кусочка магния останется одна «труха».
А вот и еще одно «чудо». В 1889 году в Париже было завершено строительство величественной башни, созданной из железа замечательным французским инженером Гюставом Эйфелем. Многие современники Эйфеля считали, что это ажурное 300-метровое сооружение окажется непрочным, ненадежным. Возражая скептикам, автор проекта утверждал, что его детище простоит не менее четверти века. Но вот прошло уже более 110 лет, а Эйфелева башня, ставшая эмблемой Парижа, до сих пор привлекает многочисленных туристов и является гордостью французов. Правда, в 1928 году некоторые американские газеты сообщили, что будто бы башня уже насквозь проржавела (безнадежно больна) и может обрушиться. Но, исследование состояния железных конструкций, проведенное французскими учеными и инженерами, показало, что это сообщение было обычной газетной «уткой». В чем же дело? Почему башня в атмосферных условиях Парижа, а не Сахары, не погибла от коррозии? Дело в том, что башня покрыта толстым слоем краски, которую непрерывно возобновляют. Краска – антикоррозионное, а не только декоративное покрытие.
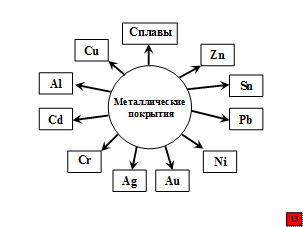
Немудрено, что проблемой защиты железа от коррозии люди заинтересовались еще в древние века. В трудах греческого историка Геродота (V век до н.э.) мы находим упоминание об оловянных покрытиях, предохраняющих железо от ржавления. В Индии приблизительно 1600 лет существует общество по борьбе с коррозией. Примерно полтора тысячелетия назад это общество приняло участие в постройке на побережье у Канареки Дворцов Солнца. И хотя позднее в течение какого-то времени территория дворцов была затоплена морем, балки, сделанные из железа, находились в отличном состоянии. Стало быть, уже в далекие времена индийские мастера знали, что можно при помощи защитных покрытий противостоять коррозии. К защитным (антикоррозионным) и декоративным покрытиям относятся и многие металлические покрытия. В настоящее время на металлургических заводах выпускают листовой прокат с покрытиями из цинка. Покрытие одного металла или сплава другим производят не только с целью защиты от коррозии и декоративной отделки, но и для повышения износостойкости, придания антифрикционных свойств, восстановления размеров изделия.
Все металлические покрытия подразделяются на катодные, электродный потенциал которых в данных условиях положительнее потенциала защищаемого металла (золото, серебро, медь, никель, хром, свинец и др. на углеродистой и низколегированной стали), и анодные, электродный потенциал которых в данных условиях отрицательнее потенциала защищаемого металла (цинк и кадмий на углеродистой и низколегированной стали, алюминий на его сплавах с медью), т.е. полярность покрытий относительно защищаемой металлической конструкции позволяет разделить их на анодные и катодные.
Катодные покрытия защищают металлическое изделие или конструкцию, механически изолируя от воздействия коррозионной среды.
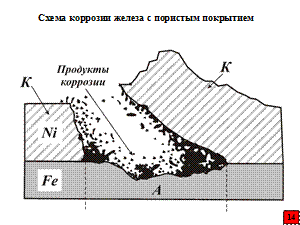
При наличии в покрытии пор, трещин и других несплошностей эти участки при осаждении тонкой пленки влаги или при погружении изделия в электролит будут интенсивно растворяться. Работает гальванический элемент, у которого вследствие большой поверхности покрытия слабо заторможен катодный процесс ассимиляции электронов (например, по реакции O2 + 2H2O + 4e→4OH-), вследствие этого скорость растворения основного металла в местах несплошности покрытия (анод) становится больше, чем у этого металлического материала без покрытия. Коррозия, начиная протекать с мест несплошностей покрытия, зачастую протекает и под ними, приводя к его отслаиванию.
Анодные металлические покрытия защищают металлическое изделие или конструкцию не только механически изолируя его от воздействия коррозионной среды, но и в результате электрохимического (протекторного) действия, т.к. в гальванической паре «защищаемый металл (пора) – анодное покрытие» обнаженные участки металла играют роль катодов и не подвержены коррозии. Вся потеря массы при коррозии металлического изделия или конструкции происходит только на анодных участках (анодах).
Цинк является анодным покрытием на стальных изделиях в обычных условиях. Однако в 1991 году представители одного предприятия были очень обижены на цинковое покрытие. Они вместо стальных трубопроводов для горячего водоснабжения толщиной 12,4 мм закупили стальные трубопроводы с цинковым покрытием толщиной 8,2 мм. Но трубопроводы с цинковым покрытием вышли из строя после 7 лет эксплуатации, а трубопроводы из аналогичной углеродистой стали продолжали функционировать после 20 лет эксплуатации, хотя и были покрыты толстым слоем ржавчины.
Обоснованной ли была их обида на цинковое (анодное) покрытие, которое должно было защищать сталь от коррозии, а не усиливать ее воздействие на данный материал? Ответ прост и все коррозиологи (ученые, занимающиеся изучением электрохимических, в том числе коррозионных, процессов) знают его. Нельзя применять цинковое покрытие для защиты стальных изделий и конструкций, когда температура водного раствора (электролита) превышает 68 ºС, т.к. электродный потенциал цинка при этой температуре становится положительнее, чем потенциал стального трубопровода. Известные американские коррозиологи Г.Г. Улиг и Р.У. Реви приводят данные, подтверждающие вышесказанное. Пятнадцатилетние эксплуатационные испытания на водопроводной воде Балтимора при средней температуре 46 ºС и максимальной 80 ºС показали, что на оцинкованной трубе глубины точечных (питтинговых) и язвенных поражений в 1,2-2 раза больше, чем на аналогичной неоцинкованной трубе из серого чугуна, и соответственно меньше срок службы оцинкованной трубы. Однако в холодной воде глубина точечных поражений составляла только 0,4-0,7 глубины питтингов на трубе из серого чугуна. Точечные поражения, как и трещины, царапины, являясь концентраторами напряжений, приводят к уменьшению прочности металлического материала и его коррозионной усталости – разрушению под одновременным воздействием коррозии, постоянных и переменных механических напряжений.
Чтобы показать, как влияют поверхностные дефекты на разрушение материалов, опишем простой и остроумный эксперимент, который провел еще в 1924 г. академик А.Ф. Иоффе. Объектом его исследований были кристаллы каменной соли. Когда их частично погружали в воду, то нижняя часть кристалла, постепенно растворяясь, становилась заметно тоньше, чем верхняя. Но вот что оказалось удивительным: если затем такой кристалл подвергали нагружению, то он вопреки известной пословице «где тонко, там и рвется» разрушался не в похудевшей, а в более толстой, оставшейся сухой, части. Мокрая же часть кристалла демонстрировала весьма высокую прочность. Вода же растворяла все, даже самые незначительные трещинки и неровности кристалла, делая его поверхность идеально гладкой, а потому и очень прочной. Обнаруженное явление получило название «Эффект Иоффе».


Дата добавления: 2015-02-07; просмотров: 1335;
