Кипение жидкостей
При достаточно низкой температуре испарение жидкости происходит с ее свободной поверхности и носит спокойный характер. По достижении определенной температуры, называемой температурой кипения, парообразование начинает происходить не только со свободной поверхности, но и в объеме жидкости. Внутри нее возникают, увеличиваются в размерах и поднимаются на поверхность пузыри пара. Парообразование приобретает бурный характер и называется кипением.Механизм кипения заключается в следующем.
В жидкости всегда есть мельчайшие пузырьки воздуха, которые, подобно броуновским частицам, совершают медленные беспорядочные перемещения в объеме жидкости. Внутри пузырьков, наряду с воздухом, имеется также насыщенный пар окружающей жидкости. Условием стабильности размера пузырька является равенство внутреннего и внешнего давлений на его поверхность. Внешнее давление равно сумме атмосферного давления 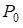 и гидростатического давления
и гидростатического давления 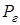 на глубине, где находится пузырек. Внутреннее давление равно сумме парциальных давлений воздуха
на глубине, где находится пузырек. Внутреннее давление равно сумме парциальных давлений воздуха 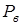 и пара
и пара 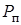 внутри пузырька. Таким образом,
внутри пузырька. Таким образом,
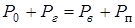 .
.
Для малых глубин, на которых гидростатическое давление мало по сравнению с атмосферным, можно положить 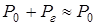 , и последнее равенство примет вид:
, и последнее равенство примет вид:
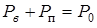 . (13.19)
. (13.19)
Если несколько увеличить температуру, то давление насыщенного пара в пузырьке возрастет и размер пузырька увеличится, давление воздуха внутри него уменьшится, так что сумма 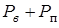 останется неизменной и условие равновесия (13.19) будет выполняться при возросшей температуре для пузырька с увеличившимся размером. Однако, если температуру увеличить настолько, что давление насыщенного пара в пузырьке станет равно атмосферному давлению,
останется неизменной и условие равновесия (13.19) будет выполняться при возросшей температуре для пузырька с увеличившимся размером. Однако, если температуру увеличить настолько, что давление насыщенного пара в пузырьке станет равно атмосферному давлению,
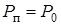 , (13.20)
, (13.20)
то равенство (13.19) перестанет выполняться. Размер пузырька и масса пара в нем будут возрастать, пузырек под действием выталкивающей (архимедовой) силы устремится к поверхности жидкости.Жидкость начнет кипеть. Итак, равенство (13.20) является условием кипения жидкости в сосуде на малой глубине: кипение жидкости на малой глубине происходит при такой температуре, при которой давление насыщенных паров этой жидкости становится равным атмосферному давлению.Таким образом, температура кипения зависит от атмосферного давления.
Пример 13.4. Вода при нормальном атмосферном давлении кипит при температуре 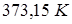 . Следовательно, давление насыщенных паров воды при этой температуре равно нормальному атмосферному давлению.
. Следовательно, давление насыщенных паров воды при этой температуре равно нормальному атмосферному давлению.
Пример 13.5. При температуре 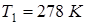 объем пузырька, находящегося в воде на малой глубине, равен
объем пузырька, находящегося в воде на малой глубине, равен 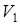 . Температура воды стала равна
. Температура воды стала равна 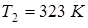 . Каким станет объем пузырька
. Каким станет объем пузырька 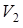 при температуре
при температуре 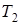 ?Атмосферное давление
?Атмосферное давление 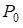 нормальное. Давление насыщенных паров воды при температуре
нормальное. Давление насыщенных паров воды при температуре 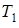 равно
равно 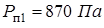 , а при температуре
, а при температуре 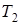 оно равно
оно равно 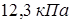 .
.
Обозначим через 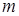 массу воздуха в пузырьке. Имеем:
массу воздуха в пузырьке. Имеем:
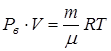 ,
,
где 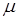 - молярная масса воздуха,
- молярная масса воздуха, 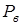 - давление воздуха в пузырьке объема
- давление воздуха в пузырьке объема 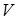 при температуре
при температуре 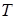 . В соответствии с условием равновесия размера пузырька (13.19) следует положить
. В соответствии с условием равновесия размера пузырька (13.19) следует положить 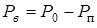 . Получим:
. Получим:
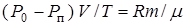 .
.
Применяя последнее равенство при двух различных температурах 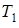 и
и 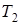 , получим:
, получим:
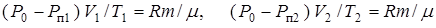 .
.
Из последних равенств находим:
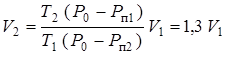 .
.
Пример 13.6. Рассмотрим раствор нелетучего вещества 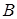 в некотором растворителе
в некотором растворителе 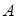 . Применяя закон Рауля (13.3), получим для давления
. Применяя закон Рауля (13.3), получим для давления 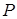 насыщенного пара над раствором:
насыщенного пара над раствором:
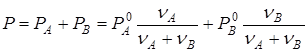 .
.
Ввиду нелетучести вещества 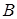 имеем
имеем 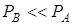 , и последнее равенство примет вид:
, и последнее равенство примет вид:
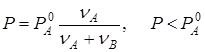 .
.
Итак, давление насыщенного пара над раствором меньше, чем над чистым растворителем (при одной и той же температуре). Отсюда следует, что раствор нужно нагреть до более высокой температуры, чем чистый растворитель, для того, чтобы давление насыщенного пара сравнялось с атмосферным и началось кипение. Таким образом, температура кипения рассматриваемого раствора выше, чем температура кипения чистого растворителя.
Задача 13.5. Найти температуру 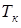 кипения воды в горах на высоте
кипения воды в горах на высоте 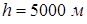 над уровнем моря. Атмосферное давление
над уровнем моря. Атмосферное давление 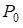 на уровне моря считать нормальным. Температуру
на уровне моря считать нормальным. Температуру 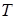 атмосферы принять равной
атмосферы принять равной 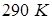 .
.
Ответ: 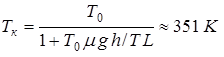 , где
, где 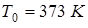 - температура кипения воды при нормальном атмосферном давлении,
- температура кипения воды при нормальном атмосферном давлении, 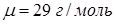 - молярная масса воздуха,
- молярная масса воздуха, 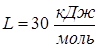 - скрытая молярная теплота испарения воды при температурах, близких к
- скрытая молярная теплота испарения воды при температурах, близких к 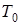 .
.
Указание. Для нахождения давления атмосферы на уровне 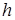 воспользоваться барометрической формулой. Для нахождения давления насыщенного пара при температуре
воспользоваться барометрической формулой. Для нахождения давления насыщенного пара при температуре 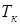 воспользоваться формулой (13.17). Использовать условие кипения (13.20).
воспользоваться формулой (13.17). Использовать условие кипения (13.20).
13.7. Превращения «жидкость - твердое тело»
При достаточно низких температурах все жидкости, за исключением жидкого гелия, переходят в твердое состояние.
Рассмотрим превращение однокомпонентной, то есть состоящей из атомов одного сорта жидкости в твердое тело. Этот процесс называется кристаллизацией. Кристаллизация является переходом системы атомов в состояние с более высокой степенью порядка и происходит при определенной температуре, называемой температурой плавления(отвердевания). При этой температуре кинетическая энергия теплового движения атомов становится достаточно малой и силы взаимодействия между атомами могут удерживать атомы в определенных положениях - узлах кристаллической решетки.
Процесс превращения твердого тела в жидкость называется плавлениеми является процессом, обратным кристаллизации. Происходит этот процесс при той же температуре, что и плавление.
Если непрерывно подводить к твердому телу тепло, то его температура будет меняться со временем так, как показано на рис. 13.4 а. Участок 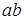 соответствует нагреванию твердого тела, участок
соответствует нагреванию твердого тела, участок 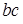 - двухфазному состоянию вещества, при котором находятся в равновесии твердая и жидкая фазы этого вещества. Таким образом, участок
- двухфазному состоянию вещества, при котором находятся в равновесии твердая и жидкая фазы этого вещества. Таким образом, участок 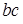 соответствует плавлению твердого тела. В точке
соответствует плавлению твердого тела. В точке 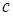 все вещество становится жидким и дальнейший подвод тепла сопровождается повышением температуры жидкости.
все вещество становится жидким и дальнейший подвод тепла сопровождается повышением температуры жидкости.
Тепло, которое подводится к системе «твердое тело - жидкость» на этапе плавления, не приводит к изменению температуры системы и идет на разрушение связей между атомами. Это тепло называется скрытой теплотой плавления.
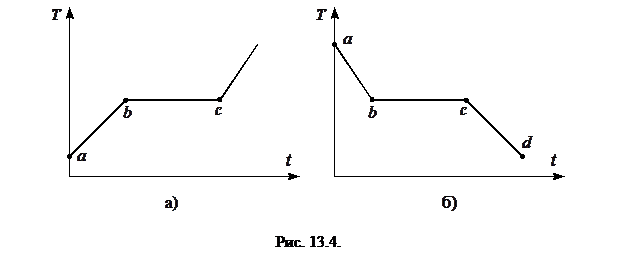 Если жидкость отдает тепло, то ее температура зависит от времени так, как показано на рис. 13.4 б. Стадия
Если жидкость отдает тепло, то ее температура зависит от времени так, как показано на рис. 13.4 б. Стадия  соответствует охлаждению жидкости, стадия
соответствует охлаждению жидкости, стадия  - ее кристаллизации (двухфазным состояниям системы), и стадия
- ее кристаллизации (двухфазным состояниям системы), и стадия  -охлаждению твердого тела. Тепло, которое отдает система на стадии кристаллизации, называется скрытой теплотой кристаллизации. Она равна скрытой теплоте плавления.
-охлаждению твердого тела. Тепло, которое отдает система на стадии кристаллизации, называется скрытой теплотой кристаллизации. Она равна скрытой теплоте плавления.
Зависимости температуры системы от времени, изображенные на рис. 13.4, характерны именно для кристаллических тел. Для аморфных веществ при их нагревании (охлаждении) график зависимости температуры от времени является монотонной кривой, что соответствует постепенному размягчению (отвердеванию) аморфного вещества при возрастании (уменьшении) его температуры.
Начинается кристаллизация в жидкости вблизи центра или центров кристаллизации. Ими служат случайные объединения атомов, к которым затем присоединяются, выстраиваясь, другие атомы, пока вся жидкость не превратится в твердое тело. Роль центров кристаллизации могут играть также инородные макроскопические частицы, если они присутствуют в жидкости.
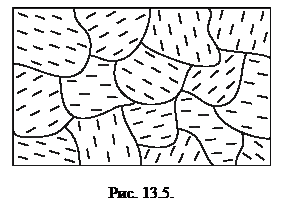 Обычно в жидкости при ее охлаждении возникает много центров кристаллизации. Вокруг этих центров формируются структуры атомов, которые в конечном итоге образуют поликристалл, состоящий из множества малых кристаллов. Условная схема поликристалла изображена на рис. 13.5.
Обычно в жидкости при ее охлаждении возникает много центров кристаллизации. Вокруг этих центров формируются структуры атомов, которые в конечном итоге образуют поликристалл, состоящий из множества малых кристаллов. Условная схема поликристалла изображена на рис. 13.5.
При особых условиях оказывается возможным получить («вырастить») одиночный кристалл - монокристалл, образующийся вокруг единого центра кристаллизации. Если при этом для всех направлений обеспечены одинаковые условия для присоединения частиц из жидкости к образующемуся кристаллу, то он получится правильно ограненнымсоответственно его свойствам симметрии.
Температура плавления 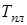 вообще-то зависит от давления, которому подвергается твердое тело, возможный ход этой зависимости изображен графически на рис. 13.6. Снять опытную зависимость
вообще-то зависит от давления, которому подвергается твердое тело, возможный ход этой зависимости изображен графически на рис. 13.6. Снять опытную зависимость 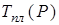 можно, например, поместив тигель с расплавляемым веществом в атмосферу газа, давление которого можно менять. Кривая зависимости
можно, например, поместив тигель с расплавляемым веществом в атмосферу газа, давление которого можно менять. Кривая зависимости 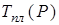 является кривой равновесия жидкой и твердой фаз. Точки под кривой
является кривой равновесия жидкой и твердой фаз. Точки под кривой 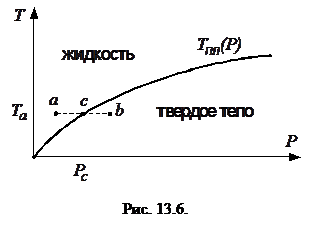 соответствуют твердому состоянию вещества, а над кривой - жидкому состоянию. Если при неизменной температуре
соответствуют твердому состоянию вещества, а над кривой - жидкому состоянию. Если при неизменной температуре 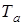 увеличивать давление над жидкостью от точки
увеличивать давление над жидкостью от точки 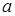 , то при давлении
, то при давлении 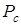 (точка
(точка 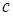 ) в жидкости возникнет твердая фаза, а при дальнейшем увеличении давления вся жидкость отвердеет (точка
) в жидкости возникнет твердая фаза, а при дальнейшем увеличении давления вся жидкость отвердеет (точка 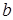 ).
).
Теоретическую связь между давлением и температурой плавления можно установить, рассмотрев цикл Карно, совершаемый двухфазной системой «твердое тело - жидкость» совершенно аналогично тому, как была установлена связь (13.12) между давлением насыщенного пара над жидкостью и температурой. Произведя в (13.12) формальные замены 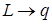 ,
, 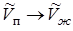 ,
, 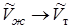 , где
, где 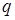 - скрытая молярная теплота плавления,
- скрытая молярная теплота плавления, 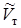 - молярный объем твердой фазы,
- молярный объем твердой фазы, 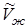 - молярный объем жидкой фазы, получим:
- молярный объем жидкой фазы, получим:
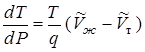 . (13.21)
. (13.21)
Если вещество не является чистым, а представляет собой сплав, то есть содержит разнородные атомы, то в общем случае отвердевание может происходить в некотором интервале температур, а не при определенной температуре, как у чистых веществ.
Задача 13.6. Уксусная кислота при атмосферном давлении плавится при температуре 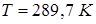 . Разность удельных объемов (то есть объемов единицы массы кислоты) жидкой и твердой фаз
. Разность удельных объемов (то есть объемов единицы массы кислоты) жидкой и твердой фаз 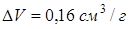 . Точка плавления уксусной кислоты смещается на
. Точка плавления уксусной кислоты смещается на 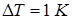 при изменении давления на
при изменении давления на 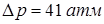 . Найти удельную (то есть отнесенную к единице массы) теплоту плавления
. Найти удельную (то есть отнесенную к единице массы) теплоту плавления 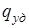 уксусной кислоты.
уксусной кислоты.
Ответ: 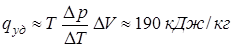 .
.
Указание. Воспользоваться формулой (13.21). Учесть, что молярный объем 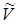 связан с удельным объемом
связан с удельным объемом 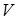 соотношением
соотношением 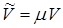 , где
, где 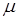 - молярная масса. Молярная теплота плавления
- молярная масса. Молярная теплота плавления 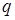 связана с удельной теплотой плавления
связана с удельной теплотой плавления 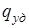 соотношением
соотношением 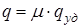 .
.
13.8. Превращения «твердое тело - пар»
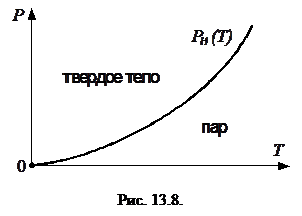
Наиболее энергичные молекулы, находящиеся на поверхности твердого тела, могут разрывать связь с его атомами. Процесс перехода вещества из твердого состояния в газообразное, минуя жидкую фазу, называется возгонкой или сублимацией. Если поместить твердое тело в закрытый сосуд с поршнем и поддерживать температуру неизменной, то при неподвижном поршне через некоторое время между твердым телом и паром над ним возникнет термодинамическое равновесие, пар станет насыщенным, рис. 13.7. Если медленно опускать поршень, то давление пара не будет меняться, но он будет конденсироваться, превращаясь в твердое вещество непосредственно, минуя жидкую фазу. При этом выделяется скрытая теплота перехода, равная сумме скрытой теплоты конденсации пара в жидкость и скрытой теплоты отвердевания жидкости. Если медленно поднимать поршень при неизменной температуре системы, то вследствие возгонки давление пара также не будет меняться. При этом система поглощает тепло, равное скрытой теплоте перехода.
 На рис. 13.8 изображена температурная зависимость
На рис. 13.8 изображена температурная зависимость 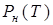 давления насыщенного пара над твердым телом. Кривая
давления насыщенного пара над твердым телом. Кривая 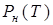 является кривой равновесия твердой и газообразной фаз. Точки этой кривой соответствуют двухфазным состояниям системы, в которых находятся в равновесии твердое тело и пар над ним. Начинается кривая при температуре
является кривой равновесия твердой и газообразной фаз. Точки этой кривой соответствуют двухфазным состояниям системы, в которых находятся в равновесии твердое тело и пар над ним. Начинается кривая при температуре 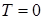 , то есть при абсолютном нуле. Точки под кривой соответствуют твердому состоянию вещества, а точки над ней - газообразному состоянию.
, то есть при абсолютном нуле. Точки под кривой соответствуют твердому состоянию вещества, а точки над ней - газообразному состоянию.
Теоретическая связь между давлением насыщенного пара над твердым телом и температурой может быть получена из рассмотрения цикла Карно, совершаемого двухфазной системой «твердое тело - пар» совершенно аналогично тому, как была получена связь (13.12) давления насыщенного пара над жидкостью и температуры. Произведем в (13.12) формальные замены 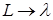 ,
, 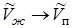 , где
, где 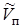 - молярный объем пара,
- молярный объем пара, 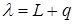 - скрытая молярная теплота перехода, равная сумме скрытой молярной теплоты плавления
- скрытая молярная теплота перехода, равная сумме скрытой молярной теплоты плавления 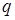 и скрытой молярной теплоты испарения
и скрытой молярной теплоты испарения 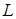 . Получим:
. Получим:
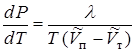 , (13.22)
, (13.22)
Задача 13.7. При температуре 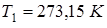 упругость насыщенного водяного пара над льдом
упругость насыщенного водяного пара над льдом 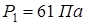 . Молярная теплота плавления льда
. Молярная теплота плавления льда 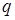 при температуре
при температуре 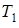 равна
равна 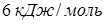 , молярная теплота испарения воды при этой температуре
, молярная теплота испарения воды при этой температуре 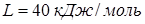 . Найти упругость
. Найти упругость 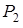 водяного пара над льдом при температуре
водяного пара над льдом при температуре 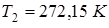 .
.
Ответ: 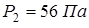 .
.
Указание. Учитывая, что 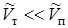 , положить в (13.22)
, положить в (13.22) 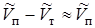 . Применить к пару уравнение состояния идеального газа.
. Применить к пару уравнение состояния идеального газа.
Дата добавления: 2015-02-05; просмотров: 3620;
