Строение электрон-транспортной цепи митохондрий
Еще в начале прошлого века было установлено, что ткани высших растений, лишенные кислорода, находясь в атмосфере чистого азота или водорода, продолжают выделять СО2. Такое дыхание было названо интрамолекулярным (внутримолекулярным) исходя из предположения, что оно осуществляется за счет кислорода самого субстрата. Позднее было показано, что этот тип дыхания, как и нормальный, связан с участием дегидрирующих ферментов, а также коферментов, переносчиков фосфатных групп и т.д.
В соответствии с современными представлениями процесс дыхания состоит из двух этапов. В ходе первого этапа, которому кислород не нужен, дыхательный субстрат, например глюкоза, распадается до ПВК, которая в ходе второго этапа может окисляться в присутствии О2 до СО2 и воды. Если же процесс превращения ПВК осуществляется в анаэробных условиях, протекает брожение с образованием СО2.
Л. Пастер первый, кто показал, что брожение есть проявление жизнедеятельности дрожжей, необходимое для поддержания их существования в бескислородной среде. Распад и окисление углеводов до стадии ПВК совершаются тождественными путями как в процессе брожения, так и аэробного дыхания. В этом заключается генетическая связь этих процессов. Вместе с тем химизм брожения более простой, чем химизм нормального кислородного дыхания. При брожении происходит лишь расщепление дыхательного материала, тогда как при дыхании идет расщепление, связанное с окислением. Так, при спиртовом брожении организмы, сбраживающие углеводы (дрожжевые клетки), обладают активной в анаэробных условиях декарбоксилазой ПВК. Под действием этого фермента от ПВК отщепляется СО2 и образуется уксусный альдегид, выступающий в качестве акцептора водорода от восстановленного НАД.
При молочнокислом брожении, осуществляемом молочнокислыми бактериями, ПВК не декарбоксилируется, а непосредственно восстанавливается с участием специфического фермента лактатдегидрогеназы. Донором водорода для этой реакции является восстановленный НАД.
Этот тип брожения часто встречается в клубнях картофеля, корнеплодах моркови и свеклы, прорастающих семенах. Если ПВК подвергается окислительному декарбоксилированию, образуется уксусная кислота.
Уксусная кислота путем конденсации превращается в ацетоуксусную, которая, восстанавливаясь, дает масляную кислоту.
Указанные реакции представляют собой возможные химические пути превращения ПВК в анаэробных условиях. Однако в ходе брожения высвобождается мало энергии, поскольку конечные продукты реакций обладают большим запасом нереализованной химической энергии. Так, 1 моль глюкозы со свободной энергией 2872,14 кДж высвобождает энергию при спиртовом брожении 118,07, при молочнокислом - около 41,87, при маслянокислом - около 62,80 кДж. Таким образом, энергетическая эффективность брожения довольно низкая.
Анаэробный и аэробный пути превращения дыхательного субстрата являются двумя сторонами единого дыхательного процесса. В отсутствие кислорода основным источником энергии в клетке служат гликолиз и брожение, а в аэробных условиях - окислительное расщепление дыхательных субстратов. О связи процессов брожения и дыхания свидетельствует также то, что в растениях выявлены те же промежуточные продукты и ферменты, что и при спиртовом брожении, даже в тканях растений, нормально снабжающихся кислородом.
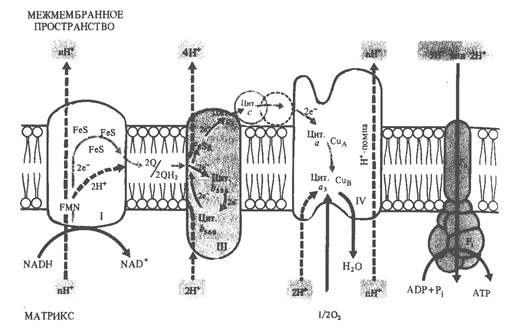
Электронтранспортная цепь митохондрий.В рассмотренных реакциях цикла Кребса и при гликолизе молекулярный кислород не участвует. Потребность в кислороде возникает при окислении восстановленных переносчиков НАД-Н и ФАДН2, в которых заключена значительная энергия. Процесс высвобождения энергии, осуществляемый постепенно, заключается в передаче электронов от НАД-Н и ФАДН2 по ЭТЦ митохондрий на свободный кислород, который, таким образом, служит терминальным акцептором электронов. Таким образом, ЭТЦ митохондрий (как и тилакоидов) выполняет функцию окислительно-восстановительной Н+-помпы.
ЭТЦ растений состоит из четырех мультибелковых комплексов и двух небольших компонентов - убихинона и цитохрома с, расположенных как на внутренней мембране митохондрий, так и внутри нее. Комплексы I, III и IV представляют собой пункты сопряжения транспорта электронов с фосфорилированием. Компоненты дыхательной цепи (переносчики электронов) в определенной мере мобильны, поскольку они как бы представляют собой составную часть жидкого липидного бислоя и, по данным Б. Чанса, расположены в определенном порядке.
Компоненты электронтранспортной цепи митохондрий растений
| Комплекс | Расположение | Состав | Характеристика | Функции комплекса |
| I | Пересекает мембрану | НАД-Н ФМН FeSN1 FeSN2 FeSN3 | Никотинамидадениндинуклеотид восстановленный Флавинмононуклеотид – кофермент дегидрогеназы, окисляющей эндогенный НАД-Н Железосерные белки (центры) | Осуществляет перенос электронов от НАД-Н к убихинону Q. Его субстратом служат молекулы внутримитохондриального НАД-Н, восстанавливающегося в ЦТК. При встраивании в фосфолипидную мембрану этот комплекс функционирует как протонная помпа |
| II | ФАД FeSS1 FeSS2 FeSS3 | Флавинадениндинуклеотид – кофермент сукцинатдегидрогеназы Железосерные белки 2Fe2S и 4Fe4S-типа | Катализирует окисление сукцината убизиноном. Эту функцию осуществляет ФАД-зависимая сукцинат:убихинон-оксидоредуктаза, в состав которой входят три железосерных центра | |
| Q | Убихинон – липидорастворимый одно- и двухэлектронный переносчик | |||
| III | Пересекает мембрану | b556 b560 c1 FeSR | Цитохромы – гемпротеины, в которых гем связан с белком нековалентно Цитохром с552 – гемпротеин, гем ковалентно связан с белком Железосерный белок Риске (2Fe2S) | Переносит электроны от восстановленного убихинона к цитохрому с, т.е. функционирует как убихинол:цитохром с-оксидоредуктаза. По структуре и функциям этот комплекс сходен с цитохромным комплексом b6 – f тилакоидов хлоропластов. В присутствии убихинона этот комплекс осуществляет активный трансмембранный перенос протонов. |
| C | На наружной стороне внутренней мембраны | Цитохром с550 – гемпротеин, гем ковалентно связан с белком, водорастворим | ||
| IV | Пересекает мембрану | a CuA a3 CuB O2, H2О | Цитохром а – гемпротеин, в котором гем нековалентно связан с белком Атом меди, функционирующий с цит.а как редокс-компонент комплекса Цитохром а3 – гемпротеин, способен взаимодействовать с кислородом Атом меди меди, функционирующий с цит.а3 при образовании комплекса с кислородом 1/2О2 + 2Н+ + 2е- ↔ Н2О | Терминальный комплекс, переносит электроны от цитохрома с к кислороду. Является цитохром с:кислород-оксидоредуктазой (цитохромоксидазой). Транспорт электронов через комплекс сопряжен с активным трансмембранным транспортом протонов. |
Следовательно, ЭТЦ представляет сложное образование, состоящее из нескольких десятков белковых молекул и лежащее между метаболитами ЦТК с одной стороны и кислородом воздуха с другой. Белки выполняют в основном структурную функцию, входят в состав сопрягающего фактора, а также являются переносчиками электронов. Простетическими группами белков-переносчиков служит, как отмечалось, наряду с флавином и гемом железо, имеющее переменную валентность и, следовательно, легко переходящее из одной формы в другую. Например, в гемсодержащих цитохромах поступающие к ним по ЭТЦ электроны восстанавливают железо, переводя его из Fe3+ в Fe2+. Каждый такой переносчик находится на несколько более низком уровне восстановленности, чем его предшественник, и в соответствии с этим содержит меньше энергии. Зная окислительно-восстановительный потенциал отдельных компонентов ЭТЦ, их можно расположить в порядке его убывания - от -0,32 у дыхательного субстрата до +0,82 у кислорода.
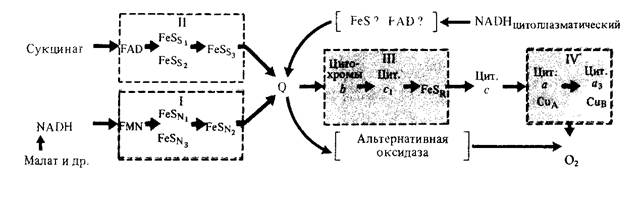
Электроны скатываются с этой «энергетической» горки благодаря разности потенциалов не сразу, а постепенно, что позволяет, во-первых, избежать неэффективного выброса энергии и, во-вторых, связать энергию в форме химических связей АТФ, образуемых из АДФ и Рн. В этом, по существу, и заключается физиологический смысл транспорта электронов.
Дата добавления: 2015-02-03; просмотров: 9646;
