Уравнение состояния полимера в растворе.
Уравнением состояния называется уравнение, связывающее давление, объем, температуру, концентрацию и другие параметры системы, находящейся в равновесии. В общем виде это уравнение можно записать так: f (P, T,V …) = 0. Уравнение состояния для растворов полимера связывает осмотическое давление с температурой, концентрацией раствора. Закон Вант-Гоффа для низкомолекулярных соединений:
Р = с . R . Т, где
Р- осмотическое давление;
с- концентрация раствора;
R- универсальная газовая постоянная;
Т- температура.
Осмотическое давление низкомолекулярных соединений прямо пропорциональна концентрации растворенного вещества. Для растворов полимеров закон Вант-Гоффа не подходит.
Для растворов полимеров подходит следующее уравнение Вандер-Ваальса:
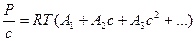 , где
, где
А1, А2, А3 , Аn – вириальные коэффициенты.
А1= 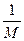 , где М- молекулярная масса полимера;
, где М- молекулярная масса полимера;
А2 – учитывает отклонения полимера от идеального поведения. Коэффициент А2 определяется по тангенсу угла наклона зависимости приведенного осмотического давления ( 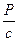 ) от концентрации раствора (с). А2 = tg a.
) от концентрации раствора (с). А2 = tg a.
1 - в хорошем растворителе А2 > 0;
2 - в Q- растворителе А2 < 0
3 – в плохом растворителе А2 < 0
Таким образом, чем больше ( 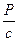 ), тем больше А2. Вериальный коэффициент А2 является мерой термодинамического сродства растворителя к полимеру.
), тем больше А2. Вериальный коэффициент А2 является мерой термодинамического сродства растворителя к полимеру.
А2 = 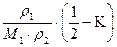 ,
,
где r1- плотность растворителя; r2 – плотность полимера; М1 – молекулярная масса растворителя; К – параметр Флори Хаггинса, т.е. параметр взаимодействия полимера с растворителем. Эта мера качества растворителя.
 Если А2 = 0 для низкомолекулярных
Если А2 = 0 для низкомолекулярных
К = 0 веществ;
 Если А2 > 0 для высокомолекулярных
Если А2 > 0 для высокомолекулярных
К < 0,5 веществ;
 Если А2 = 0 идеальный
Если А2 = 0 идеальный
К = 0,5 растворитель;
 Если А2 > 0 хороший
Если А2 > 0 хороший
К < 0,5 растворитель;
 Если А2 < 0 плохой
Если А2 < 0 плохой
К > 0,5 растворитель.
Дата добавления: 2015-02-03; просмотров: 2593;
