Гидродинамические свойства макромолекул в разбавленных растворах.
Метод вискозиметрии позволяет получить такие характеристики макромолекул, как молекулярная масса, размеры, коэффициент набухания макромолекулярного клубка, степень полдисперсности макромолекул. Вязкость (внутреннее трение жидкости) обусловлена взаимодействием молекул жидкости и проявляется при ее течении.
Вязкость полимеров определяют прибором, который называется вискозиметром.
При исследовании разбавленных растворов полимеров определяют не абсолютную, а относительную вязкость ηотн, т.е. отношение вязкости растворов полимера η к вязкости чистого растворителя ηо, которое при условии, что плотности разбавленного раствора и чистого растворителя совпадают, равно ηотн = η/ηо = τ/τо, где τ и τо время истечения раствора и чистого растворителя.
Удельная вязкость ηуд = η-ηо/ηо показывает относительный прирост вязкости вследствие введения в растворитель полимера;
Приведенная вязкость раствора ηпр=ηуд./с
lim ηуд./с при с → 0, называется характеристической вязкостью [η] .
Характеристическая вязкость полимера зависит от размеров макромолекулы в растворе, от природы растворителя и температуры раствора.
[η] =К. 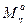 - уравнение Марка-Куна-Хаувинка, где
- уравнение Марка-Куна-Хаувинка, где
a- константа, связанная с конформацией макромолекулы в растворе.
Молекулярная масса полимера, определенная по уравнению Марка-Куна-Хаувинка, является средневязкостной Мη.
Для гибких макромолекул в хороших растворителях а = 0,6-0,8 ;
Для жестких макромолекул a = 1,0-1,5;
Для палочкообразных частиц a = 2,0 .
Таким образом, «α» изменяется в пределах 0 £ a ³ 2,0.
Константы К и a находят, представив уравнение Марка-Куна-Хаувинка в логарифмической форме:
lg[ η] = lg К+a lg M
Молекулярные масс серии узких фракций полимера определяют с помощью какого- либо абсолютного метода (осмометрии, светорассеяния и др.). Из прямолинейной зависимости lg[ η] от lg M находят К и a.
Зависимость приведенной вязкости от концентрации раствора полимера описывается уравнением Хаггинса:
ηуд./с = [ η] + К’. [ η] . c, где
К’ – константа Хаггинса, характеризующая взаимодействие макромолекул в данном растворителе. В хороших растворителях К/= 0,2-0,3, а в плохих К/³ 0,5;
Дата добавления: 2015-02-03; просмотров: 2683;
