Вопрос 4 Простые и сложные белки. Строение, характеристика отдельных групп, биологическая роль
Белки классифицируются на простые и сложные.
Простые белки построены из остатков аминокислот и при гидролизе распадаются соответственно только на свободные аминокислоты. К простым белкам относят гистоны, протамины, альбумины, глобулины.
Альбумины и глобулины относятся к белкам, широко распространенным в органах и тканях животных.
Альбумины - это белки небольшой молекулярной массы (70 тыс.), они имеют избыточный "-" заряд и кислые свойства из-за большого содержания глутаминовой кислоты. Высаливаются при 100% насыщении (NH4)2SO4. Характерная их особенность - высокая адсорбционная способность, благодаря чему они могут выполнять транспортную роль. Альбумины поддерживают осмотическое давление, обуславливают рН крови, выполняют резервную функцию.
Глобулины - белки с большей молекулярной массой (в пределах 160-180 тыс.). Они слабокислые или нейтральные. Это неоднородная фракция, среди которой особо выделяют α1, α2, β, γ-глобулины. Глобулины выполняют защитную функцию, участвуют в свертывании крови, осуществляют транспорт холестерола, ряда витаминов, гормонов, ферментов, ионов меди и железа.
Гистоны - это белки основного характера, с молекулярной массой 12000-24000. Основные их функции заключаются в стабилизации пространственной структуры ДНК, а, следовательно, хроматина и хромосом. Регуляторная функция этих белков заключается в способности блокировать передачу генетической информации от ДНК к РНК.
Протамины значительно отличаются аминокислотным составом и структурой, обладают резко выраженными основными свойствами из-за большого (80%) содержания аргинина. Их молекулярная масса не превышает 5000. Они, как и гистоны, поликатионные белки и связываются с ДНК в хроматине спермиев.
Сложные белки содержат два компонента: белковую и небелковую части, называемые простетической группой. В зависимости от характера этой группы различают: хромопротеины, нуклеопротеины, металлопротеины, фосфопротеины, гликопротеины, липопротеины.
2.2 Хромопротеины. Гемопротеины, химическое строение гемоглобина, миоглобина. Аномальные гемоглобины.
Хромопротеины. Их подклассом являются гемопротеины, к которым относятся гемоглобин (Нb), миоглобин, цитохромы, каталаза.
Нb А1 имеет четвертичную структуру. Его молекулярная масса равна 66 000-68 000. Глобин - это белковая часть, состоящая из 4-х субъединиц, а каждая из субъединиц обозначается α, β. Всего 2 α-цепи, содержащие по 141 аминокислотному остатку и 2 β- по 146 аминокислот. Вторичные их структуры представлены в виде спиральных сегментов различной длины. Третичные структуры α- и β-цепей очень сходны. Внутри каждой субъединицы имеется гидрофобный "карман", в котором удерживается гем, благодаря ван-дер-ваальсовым связкам между неполярными участками гема и гидрофобными радикалами аминокислот (этих связей около 60). Гем - это тетрапиррольное соединение с атомом Fе+2, соединенного с азотами пирролов, 5-я связь с имидазольным кольцом гистидина глобина. Шестая координационная связь Fе+2 свободна и используется для связывания кислорода и других лигандов. 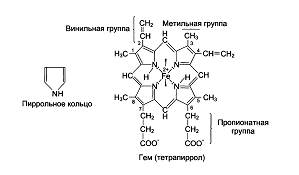
Белковая часть молекулы Нb влияет на свойства гема. Молекула Нb взаимодействует с различными лигандами. Очень высоко сродство Нb к оксиду углерода (II) - СО примерно в 300 раз больше, чем к О2, что говорит о высокой токсичности угарного газа. Эта форма носит название карбоксигемоглобина, Fe+2 не меняет валентности. При действии окислителей (например, нитрата натрия) образуется метгемоглобин, в котором Fe в степени окисления +3. Появление метгемоглобина в больших количествах вызывает кислородное голодание тканей. Наилучшим методом распознавания отдельных производных гемоглобина является исследование их спектров поглощения.
Возможно образование еще одного производного Нb - карбгемоглобина, когда Нb связывается с СО2, однако СО2 присоединяется не к гему, а к NH2 - группам глобина (НbNH2+СО2→ НbNHCOO-+Н+). Образование карбгемоглобина используется для выведения СО2 из тканей к легким. Этим путем выводится 10-15% СО2.
Гемоглобины могут различаться по белковой части, в связи с этим существуют физиологические и аномальные типы Нb.
Физиологические Нb образуются на разных этапах нормального развития организма, а аномальные - вследствие нарушений последовательности аминокислот в глобине.
Физиологические типы гемоглобинов отличаются друг от друга набором полипептидных цепей. Различают гемоглобины взрослых Нb А1 (96%), Нb А2 (2-3%), состоящий из 4 субъединиц: двух α-цепей и двух δ-цепей. Известен, кроме того, фетальный гемоглобин (гемоглобин новорожденных), обозначаемый HbF и состоящий из двух α-цепей и двух γ-цепей (1-2%). Нb А2 и Нb F обладают большим сродством к кислороду, чем Нb А1.
Общая группа заболеваний, связанная с Нb, носит название гемоглобинозов. Различают среди них гемоглобинопатии, например серповидноклеточная анемия, когда происходит замена при синтезе β-цепи в 6-ом положение глутаминовой кислоты на валин в β-цепях молекулы гемоглобина S. Эритроциты приобретает форму серпа, понижается сродство к О2. Болезнь протекает остро, и дети, гомозиготные по мутатному гену, часто умирают в детском возрасте.
Талассемия - это заболевание, при котором полностью нарушается синтез либо цепи α или β (отсюда и название α-талассемия или β-талассемия). При β-талассемии в крови наряду с HbA1 появляется до 15% НЬА2 и резко повышается содержание HbF – до 15–60%. Болезнь характеризуется гиперплазией и разрушением костного мозга, поражением печени, селезенки, деформацией черепа и сопровождается тяжелой гемолитической анемией. Эритроциты при талассемии приобретают мишеневидную форму.
Миоглобин имеет третичную структуру и представляет собой одну цепь Нb (153 аминокислоты). В отличие от Нb он в 5 раз быстрее связывает О2. Кривая насыщения имеет вид гиперболы. В этом кроется большой биологический смысл, поскольку миоглобин находится в глубине мышечной ткани (где низкое парциальное давление О2). Связывая О2, миоглобин создает кислородный резерв, который расходуется по мере необходимости, восполняя временную нехватку О2.
Гликозилированный гемоглобин. Гликозилированные белки.
Одним из основных механизмов повреждения тканей, в частности, при сахарном диабете является гликозилирование белков, приводящее к изменению их конформации и функций. Некоторые белки в норме содержат углеводные компоненты, причем образование таких гликопротеинов протекает ферментативно. Однако в организме человека может происходить и неферментативоне взаимодействие глюкозы со свободными аминогруппами белков- неферментативное гликозилирование белков. Неферментативное гликозилирование четко связано с гипергликемией. Это бывает при нарушении углеводного обмена, когда количество глюкозы в крови значительно больше нормы и, прежде всего, при сахарном диабете. Глюкоза крови при сахарном диабете в отсутствие инсулина не может проникнуть в ткани организма и связывается (ее альдегидная форма) с различными белками. Белки в этих комплексах меняют свои физико-химические свойства, при этом уменьшаются или теряются функции, выполняемые этими белками. Известны гликозилированный гемоглобин, гликозилированный альбумин, гликозилированный коллаген, гликозилированные липопротеины.
Гликозилирование гемоглобина идет в 2 этапа:
1. Глюкоза неферментативно соединяется своей карбонильной группой с N-концевым остатком бета-цепей валина. Эта стадия обратима.
2. Гликозилированный гемоглобин подвергается переустройству с образованием кетоамина. Эта стадия необратимая.
Известно, что эритроциты больных сахарным диабетом содержат процент минорного компонента Нb, так называемый гликозилированный Нb (Нb А1с).
К патогенезу осложнения диабета можно отнести тот факт, что у больных увеличивается количество Нb А1с (до 12-15%) по сравнению с допустимой концентрацией 4-6%. Так, при недостаточно компенсированном диабете общее соединение Нb А1с превышает 12%. Гликозилированный гемоглобин отражает процент гемоглобина крови, необратимо соединённый с молекулами глюкозы. Повышение уровня глюкозы крови при сахарном диабете значительно ускоряет данную реакцию, что приводит к повышению уровня гликозилированного гемоглобина в крови. Время жизни эритроцитов, которые содержат гемоглобин, составляет в среднем 120—125 суток. Именно поэтому уровень гликозилированного гемоглобина отражает средний уровень гликемии на протяжении примерно трёх месяцев. Чем выше уровень гликозилированного гемоглобина, тем выше была гликемия за последние три месяца и, соответственно, больше риск развития осложнений сахарного диабета.
Поражение сердечно-сосудистой системы является клиническим проявлением сахарного диабета. Микроангиопатия является причиной инвалидности и смерти больных. В возникновении микроангиопатий определенную роль играет гликозилирование белков, что приводит к возникновению нефро- и ретинопатии (катаракта, нарушение функции почек)
Коллаген составляет основу базальных мембран капилляров. Повышенное содержание гликозилированного коллагена ведет к уменьшению его эластичности, растворимости, к преждевременному старению, развитию контрактур. В почках такие изменения приводят к запустению клубочков и хронической почечной недостаточности.
Гликозилированные липопротеины, накапливаясь в сосудистой стенке, приводят к развитию гиперхолестеринемии и липидной инфильтрации. Они служат основой атером, происходит нарушение сосудистого тонуса, что приводит к атеросклерозу.
Гликопротеины. Химическое строение, биологическая роль.
Гликопротеины – сложные белки, содержащие, помимо простого белка или пептида, группу гетероолигосахаридов (содержание углеводов варьирует от 1 до 85%). В настоящее время их принято называть гликоконъюгатами. В состав гликоконъюгата входит углеводный компонент (гликановая фракция), ковалентно связанный с неуглеводной частью (агликановая фракция), представленной белком, пептидом, аминокислотой или липидом.
Гликопротеины классифицируются на истинные и протеогликаны. Моносахариды, связанные с конкретным белком, могут быть разными: это может быть глюкоза, фруктоза, манноза, глюкозамин, галактозамин, фруктозамин, сиаловая кислота и др. Те или иные моносахариды, связанные с белком, изменяют биохимические и иммунологические свойства белка, его пространственную конфигурацию и др. Важным частным случаем является связывание белков с сиаловой кислотой, приводящее к формированию сиалогликопротеинов.
Протеогликаны- высокомолекулярные соединения, состоящие из белка (5-10%) и гликозаминогликанов (гетерополисахаридов) (90-95%), напр. гиалуроновая кислота, хондроитинсульфаты. Они образуют основное вещество межклеточного матрикса соединительной ткани, выполняя «смазочную» функцию, что объясняется их способностью связывать большое количество воды, в результате чего межклеточное вещество приобретает желеобразный характер.
Гликопротеины выполняют разнообразные функции:
1) структурные молекулы
- клеточная стенка
- коллаген, эластин
- фибрины
- костный матрикс
2) "смазочные" и защитные агенты
- муцины
- слизистые секреты
3) транспортные молекулы для:
- витаминов
- липидов
- минералов и микроэлементов
4) иммунологические молекулы
- иммуноглобулины
- антигены гистосовместимости
- комплемент
- интерферон
5) гормоны
- хорионический гонадотропин
- тиреотропин
6) ферменты
- протеазы
- нуклеазы
- гликозидазы
- гидролазы
- факторы свертывания
7) места клеточных контактов/ распознавания
- клетка - клетка
- вирус - клетка
- бактерия - клетка
- гормональные рецепторы
2.5 Фосфопротеины. Химическое строение, биологическая роль.
Фосфопротеины- сложные белки, содержащие в качестве небелковой части остатки фосфорной кислоты. Фосфорная кислота в фосфопротеинах связана с гидроксильной группой серина и треонина, входящих в состав белка, эфирной связью. К ним относятся казеины - белки молока, вителлин яичного желтка, пр. Биологическая роль фосфопротеинов заключается в том, что они служат питательным материалом для эмбрионов и растущих организмов, являясь источником аминокислот и фосфорной кислоты. Фосфопротеины выполняют также энергетическую функцию, участвуя в образовании макроэргических молекул (АТФ, ГТФ), и пластическую функцию (входят в состав нуклеотидов, цАМФ). Особо следует отметить, что некоторые ключевые ферменты, регулирующие процессы внутриклеточного обмена веществ, существуют как в фосфорилированной, так и в дефосфорилированной форме. Этим подчеркивается значение акта фосфорилирования–дефосфорилирования, регулирующего процессы химической модификации макромолекул, участвующих в интегральных процессах метаболизма.
·
Дата добавления: 2015-02-03; просмотров: 7652;
