Комлексонометрія
Метод комплексонометрії ґрунтується на реакції комплексоутворення катіонів металів з комплексонами. Комплексони – похідні амінополікарбонових кислот:
– комплексон ІІ – етилендіамінтетраацетатна кислота (ЕДТА);
– комплексон ІІІ – динатрієва сіль цієї кислоти (трилон Б):
 CH2COONa
CH2COONa

 СН2 – N
СН2 – N
 CH2COOH
CH2COOH
(умовно Н2Na2R)
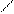
 CH2COOH
CH2COOH

 СН2 – N
СН2 – N
CH2COONa
· Суть метода:
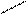
 CH2COONa CH2COONa
CH2COONa CH2COONa

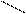

 СН2 – N CH2 – N
СН2 – N CH2 – N
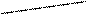

 CH2COOH CH2COO
CH2COOH CH2COO
 +Ме2+ → Ме2+ + 2H+
+Ме2+ → Ме2+ + 2H+

 CH2COOH CH2COO
CH2COOH CH2COO
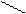

 СН2 – N CH2 – N
СН2 – N CH2 – N
CH2COONa CH2COONa
Або схематично: Ме2+ + Н2Na2R → МеNa 2R + 2Н+
· Робочий розчин:
0,1н або 0,05н розчин трилону Б
· Первинний стандарт:MgSO4 · 7H2O – магній сульфат
· Стандартизація робочого розчину:
MgSO4 + Н2Na2R → МgNa 2R + Н2SO4
· Індикатори металохромні –це кольорові органічні сполуки, які утворюють комплекси з іонами металів, забарвлені в інший колір:
Ме2+ + Н2Ind → МеInd + 2Н+
У процесі титрування розчином трилону Б комплекси МеInd руйнуються, і в точці еквівалентності розчин набуває забарвлення вільного індикатора:
МеInd + Н2Na2R → МеNa 2R + Н2Ind
Основна умова для використання того чи іншого металохромного індикатора – його комплекс з металом повинен бути менш стійким, ніж комплекс цього метала з трилоном Б.
| Індикатор | МеInd | Н2Ind |
| еріохром чорний Т (хромоген чорний) хромоген темно-синій мурексид | винно-червоний рожевий червоний | синій синій фіолетовий |
· Умови комплексонометрії:
1 –відсутність побічних реакцій;
2 – різкий перехід забарвлення індикатору;
3 – точне дотримування рН розчину, що титрується.
При взаємодії з трилоном Б катіони металу витісняють іони Н+. Для їх зв’язування перед початком титрування у розчин додають аміачну буферну суміш NH4OH + NH4Cl (рН 8,0 – 10,0). Але рН розчину не повинно бути вище 10,0, тому що в цьому випадку випадає осад гідроксиду металу.
Титрування деяких катіонів проводять з ацетатною буферною сумішшю СН3СООН + СН3СООNа (рН 6,0).
· Застосування методу комплексонометрії:
P визначення катіонів:
–пряме титрування–катіониZn2+, Mg2+, Ca2+, Ba2+, Cd2+, Ni2+ та інші;
– зворотне титрування – катіони Al3+, Fe3+. Ці метали повільно реагують з трилоном Б, тому до досліджуваного розчину додають розчин трилону Б в надлишку, а через деякий час його надлишок відтитровують розчином ZnSO4 або MgSO4;
P визначення аніонів (зворотне титрування):
наприклад, аніони SO42– осаджують надлишком BaCl2, а катіони Ва2+, що не зв’язалися з SO42–, відтитровують розчином трилону Б.
Дата добавления: 2015-02-03; просмотров: 1389;
