Горение углерода
Взаимодействие углерода с кислородом описывается реакциями 1-4. Это взаимодействие имеет место во многих металлургических системах. Рассмотрим его на примере процесса ваграночной плавки. В условиях слоевого взаимодействия углерода (кокса) с кислородом и продуктами горения происходит сложный гетерогенный процесс, конечные результаты которого оказывают влияние на особенности химических реакций, физического переноса газообразных компонентов к поверхности твердого топлива и отвода продуктов реакций.
Реакции 1, 2 и 3 могут протекать в окислительных условиях, то есть когда в реагирующем пространстве имеется достаточное количество свободного кислорода. Реакция 4 протекает в восстановительных условиях, то есть когда имеется избыток углерода (или дефицит кислорода). Максимальное выделение теплоты характерно для реакции 1. Причем ΔН1= ΔН2+ ΔН3 (закон Гесса).
Термодинамический анализ рассматриваемых реакций позволяет оценить условия их преимущественного развития и прочность получаемых при этом химических соединений.
Рассмотрим температурную зависимость изменения изобарно-изотермических потенциалов реакций, представленную на рис. 6.

Рис. 6. Температурная зависимость 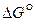 реакций горения углерода
реакций горения углерода
Отрицательные значения 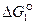 являются показателем того, что реакция 1 самопроизвольно развивается в стандартных условиях. Большое числовое значение
являются показателем того, что реакция 1 самопроизвольно развивается в стандартных условиях. Большое числовое значение 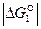 характеризует значительную степень сродства углерода и кислорода и прочность образовавшегося углекислого газа СО2. Реакция 1 завершается с большой степенью полноты, является необратимой, а полученный углекислый газ не может разлагаться с выделение углерода.
характеризует значительную степень сродства углерода и кислорода и прочность образовавшегося углекислого газа СО2. Реакция 1 завершается с большой степенью полноты, является необратимой, а полученный углекислый газ не может разлагаться с выделение углерода.
Числовые значения 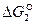 показывают, что при высоких температурах проявляется значительное химическое родство углерода и кислорода с образованием СО. Реакция необратима. С повышением температуры прочность СО возрастает. При понижении температуры прочность СО понижается и возрастает сродство СО и кислорода по реакции 3.
показывают, что при высоких температурах проявляется значительное химическое родство углерода и кислорода с образованием СО. Реакция необратима. С повышением температуры прочность СО возрастает. При понижении температуры прочность СО понижается и возрастает сродство СО и кислорода по реакции 3.
Положение прямой температурной зависимости 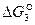 в области пониженных числовых значений сродства СО и О2 и уменьшение ее с повышением температуры является свидетельством неполного завершения реакции и ее обратимости. Следовательно, диссоциация углекислого газа СО2 возможна только с образованием СО и О2, но невозможна с выделением свободного углерода.
в области пониженных числовых значений сродства СО и О2 и уменьшение ее с повышением температуры является свидетельством неполного завершения реакции и ее обратимости. Следовательно, диссоциация углекислого газа СО2 возможна только с образованием СО и О2, но невозможна с выделением свободного углерода.
При диссоциации СО образуется углерод и углекислый газ и невозможно выделение свободного кислорода.
Константы равновесия реакций 1 и 2:
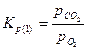
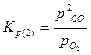
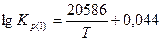
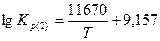
В реальных условиях в той или иной степени получают развитие все четыре реакции. При этом следует учитывать не только химические, но и физические особенности процесса. В газовой фазе, кроме диффузионного взаимодействия, имеет место конвективный перенос О2, СО и СО2. Кокс, используемый в большинстве случаев в качестве топлива в вагранках, характеризуется определенной степенью пористости. Газовые реагенты проникают в макро- и микропоры, в которых развиваются те или иные химические реакции, идет так называемое внутреннее реагирование. В сложной цепи химических реакций имеются звенья, определяющие кинетику всего процесса. В условиях слоевого горения топлива таким звеном является суммарный расход кислорода на химические реакции и диффузионный перенос его в реакционную зону.
Если преимущественным является процесс окисления углерода внутри топлива в порах и трещинах, то узким звеном процесса является перенос кислорода во внутрь кусков топлива, где преимущественно происходит окисление углерода до СО. Если в газовой фазе имеется избыток кислорода, то образовавшийся СО может догореть до СО2. При этом задерживается доставка кислорода во внутренние слои топлива и создается его дефицит.
При слоевом горении твёрдого углеродсодержащего топлива различают две переходящие друг в друга зоны: окислительную и восстановительную.
Окислительная или кислородная зона начинается от границы первичного взаимодействия с дутьем и продолжается вглубь до того места, где в газовой фазе исчезает свободный кислород. В этой зоне образуются СО2 и СО. С понижением в газовой фазе концентрации кислорода в ней увеличивается количество СО. В связи с отсутствием в газовой фазе кислорода в слое топлива развивается эндотермическая реакция 4 взаимодействия СО2 и С.
Максимальной концентрации СО2 в слое топлива соответствует и наибольшая температура. По мере увеличения в газовой фазе СО температура в слое топлива понижается.
Установлено, что длина кислородной зоны мало зависит от скорости дутья. Концентрация СО в газовой фазе в значительной степени зависит от температурного режима.
Изменение состава газовой фазы сопровождается изменением её свойств. При увеличении в ней концентрации СО её восстановительные свойства увеличиваются, а окислительные уменьшаются.
В зависимости от соотношения в газовой фазе СО2 и СО, она в одном случае может быть источником углерода и науглероживать металлы и сплавы, в других - поглощать углерод и обезуглероживать металлы и сплавы.
Горение водорода и оксида углерода СО протекают по цепному механизму. Особенность горения СО состоит в том, что её скорость существенно зависит от содержания в системе водорода и водяных паров. Реакция водяного газа в прямом и обратном направлениях идёт в присутствии твердых катализаторов.
Дата добавления: 2015-01-29; просмотров: 1323;
