Опис лабораторної установки і методика вимірювання
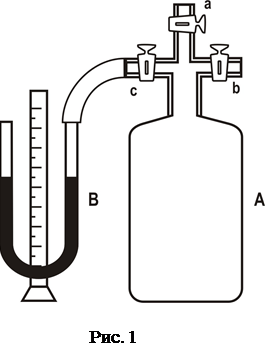
| |
Для визначення відношення теплоємностей 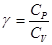 повітря, що знаходиться в балоні, з ним проводять послідовність термодинамічних процесів, представлених на рV-діаграмі, рис.2.
повітря, що знаходиться в балоні, з ним проводять послідовність термодинамічних процесів, представлених на рV-діаграмі, рис.2.
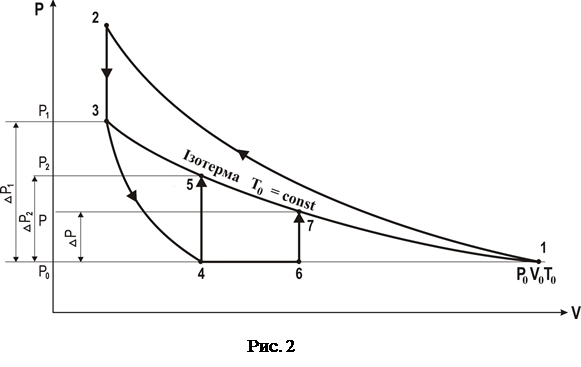
Позначимо через Р0 , V0 , T0 вихідні величини термодинамічних параметрів газу в балоні. Спочатку в балон накачується повітря (процес 1®2 ). При цьому газ в балоні стискається і нагрівається. Потрібен деякий час на вирівнювання температури повітря всередині балону з температурою оточуючого середовища. Після ізохоричного охолодження до початкової кімнатної температури Т0 (процес 2®3) газ має деякий тиск Р1, а на манометрі встановиться певна різниця висот рівнів h1.
Потім краном а з’єднують балон з атмосферою і газ адіабатично розширюється (процес 3®4). Газ при цьому охолоджується, його тиск падає до величини атмосферного Р0 , а температура – до величини Т1< Т0.
В момент досягнення тиску Р0 кран а перекривається, і газ ізохорично нагрівається до кімнатної температури Т0 (процес 4®5). В кінцевому стані тиск газу Р2 > Р0, а на манометрі встановиться різниця висот рівнів рідини h2 < h1.
Маса газу, що знаходиться в балоні, в початковому стані виражається співвідношенням
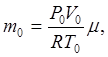 (1)
(1)
Протягом всіх термодинамічних процесів маса газу в балоні більше або дорівнює m0. Назвемо масу m0 робочою масою газу. Ця маса повинна весь час залишатися в балоні. Газ, що накачується і випускається з балону, служить лише для стискання і розширення робочої маси газу m0.
Введемо позначення DР1 = Р1 – Р0 і DР2 = Р2 – Р0. Оскільки перехід з 3-го в 4-й стан здійснюється адіабатично, то можна записати:
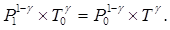 (2)
(2)
Перехід з 4-го стану в 5-й здійснюється ізохорично, отже:
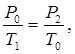 (3)
(3)
Виключивши з рівнянь (2) і (3) температуру Т1 і скоротивши потім на 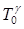 , отримаємо
, отримаємо
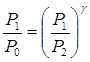 або
або 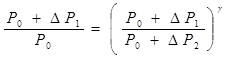
 (4)
(4)
Розв’яжемо рівняння (4) відносно показника адіабати:
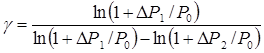 . (5)
. (5)
У роботі завжди виконується умова 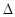 P1,
P1, 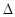 P2 << P0 , що еквівалентно умові
P2 << P0 , що еквівалентно умові 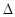 P1/P0,
P1/P0, 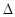 P2/ P0 << 1. Остання умова дозволяє з точністю до членів другого порядку малості (
P2/ P0 << 1. Остання умова дозволяє з точністю до членів другого порядку малості ( 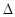 P1/P0)2 замінити у (5) логарифми – першими членами їх розкладу у ряди Тейлора, тобто відповідно:
P1/P0)2 замінити у (5) логарифми – першими членами їх розкладу у ряди Тейлора, тобто відповідно:
ln( 1 + 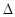 P1/P0)
P1/P0) 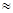
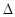 P1/P0; ln( 1 +
P1/P0; ln( 1 + 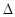 P2/P0)
P2/P0) 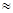
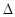 P2/P0 .
P2/P0 .
Таким чином, отримаємо:
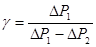 або
або 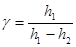 (6)
(6)
Отже, при такому методі розрахунку необхідно виконання наступних умов:
1. В процесі 3®4 кран балону повинен бути перекритий в момент, коли тиск в балоні буде дорівнювати Р0.
2. Час, протягом якого тиск в балоні зменшується від Р1 до Р0 , повинен бути достатньо малим, так щоб теплообміном з оточуючим повітрям можна було знехтувати.
Розглянемо вплив часу t, протягом якого кран а ще залишається відкритим після досягнення тиску Р0, на результат дослідження.
Припустимо, що після досягнення тиску Р0 кран залишається відкритим ще деякий час t. За цей час відбувається ізобаричне нагрівання (процес 4®6) за рахунок теплообміну газу зі стінками балону, а також вихід частини газу з балону, викликаний нагріванням і розширенням цього газу. Величину t назвемо часом затримки.
Після того, як кран а закривається (точка 6), відбувається ізохоричне нагрівання (процес 6®7). Тиск в балоні досягає величини Р0 + DР. Кінцевий стан: точка (7) лежить на тій самій ізотермі, що і точки 1, 3 і 5, але DР < DР1.
З цього розгляду видно, що DР залежить від часу затримки t. Таким чином, якщо прийняти до уваги теплообмін і вихід частки газу з балону за час t, то g, розраховане за формулою (7), буде мати велику похибку.
Розглянемо детальніше процес охолодження протягом часу t. Рівняння балансу енергії для газу, що знаходиться в балоні, може бути записано у вигляді
- m сP d T = a S (T – T0) d t, (10)
де сP – питома теплоємність газу; a - коефіцієнт тепловіддачі з поверхні балону;
m – змінна маса газу в балоні ( 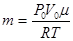 ); Т – температура газу в момент часу t; S – площа поверхні балону з повітрям.
); Т – температура газу в момент часу t; S – площа поверхні балону з повітрям.
Розв’язуючи це рівняння, отримаємо вираз:
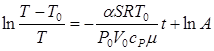
Константу інтегрування А знайдемо з умови: при t = 0 Т1 = Т0 - DТ1. Кінцеве співвідношення буде мати вигляд:
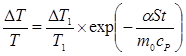 . (11)
. (11)
Температура газу Т тим більша, чим більший час витримки t. Після того, як в момент часу t кран а перекривається, нагрівання газу в балоні продовжується ізохорично. Тиск газу остаточно досягає величини
Р = Р0 + DР.
З умови ізохоричності виходить, що
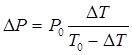 , (12)
, (12)
Для малих DР1 і DТ1 з рівняння адіабатичного процесу (3®4) виходить співвідношення: 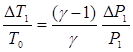 (13)
(13)
Підставляючи співвідношення (12) і (13) в (11) і нехтуючи членами другого порядку малості, отримуємо формулу
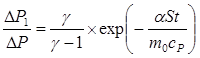 , (14)
, (14)
Це відношення враховує як теплообмін, так і вихід частини газу з балону в процесі нагрівання. Співвідношення (14) дозволяє знайти g за виміряними при різних величинах t значеннями DР1 і DР. Графік залежності 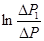 від часу витримки t є лінійною функцією. Якщо екстраполювати цей графік до t = 0, то він буде відсікати на осі ординат відрізок:
від часу витримки t є лінійною функцією. Якщо екстраполювати цей графік до t = 0, то він буде відсікати на осі ординат відрізок: 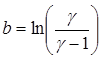 , (15)
, (15)
З рівняння (15) легко знаходиться відношення теплоємностей
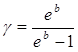 , (16)
, (16)
Дата добавления: 2015-01-29; просмотров: 1029;
