Тема 8. Молекулярно - кинетическая теория идеальных газов
Молекулярная физика и термодинамика - разделы физики, в которых изучаются макроскопические (параметры) процессы в телах, связанные с огромным числом атомов и молекул, содержащихся в телах.
Для исследования этих процессов применяют два метода: статистический (молекулярно-кинетический) и термодинамический.
Молекулярная физика изучает строение и свойства вещества, исходя из молекулярно – кинетических представлений, основывающихся на том что:
1) все тела состоят из молекул
2) молекулы непрерывно и беспорядочно движутся
3) между молекулами существуют силы притяжения и отталкивания - межмолекулярные силы.
Статистический метод основан на том, что свойства макроскопической системы определяются, в конечном счете, свойствами частиц системы.
Термодинамика – изучает общие свойства макроскопических систем, находящихся в состоянии термодинамического равновесия, и процессы перехода между этими состояниями и не рассматривает микропроцессы, которые лежат в основе этих превращений. Этим термодинамический метод отличается от статистического метода. Основа термодинамического метода – определение состояния термодинамической системы.
Термодинамическая система – совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией между собой и внешней средой.
Состояние системы задается термодинамическими параметрами: p, V, T.
Применяют две шкалы температуры: Кельвина и Цельсия.
T = t + 2730 - связь между температурами t и Т
где t - измеряется в Цельсиях 0 С ; Т - измеряется в кельвинах К.
В молекулярно – кинетической теории пользуются моделью идеального газа, согласно которой:
- собственный объем молекул газа пренебрежимо мал по сравнению с объемом сосуда
- между молекулами газа отсутствуют силы взаимодействия
- столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
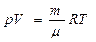 Состояние идеального газа характеризуется 3 параметрами: p, V, T.
Состояние идеального газа характеризуется 3 параметрами: p, V, T.
- уравнение Менделеева - Клайперона
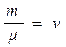 или уравнение состояния идеального газа
или уравнение состояния идеального газа
здесь: - количество вещества [моль]
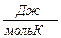
R = 8,31 - универсальная газовая постоянная
Опытным путем был установлен целый ряд законов, описывающих поведение идеальных газов.
Рассмотрим эти законы:
1) T – const – изотермический процесс
 р
р
T –растет pV = const -
закон Бойля – Мариотта
V
2)  p = const - изобарный процесс
p = const - изобарный процесс
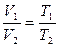 V
V
p2-const - закон Гей - Люссака
p1 p2
p1>p2
Т
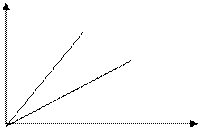
3) V – const – изохорный процесс
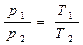
 р
р
V1 - закон Шарля
V2
V1>V2
T
4) Закон Авогадро: моли любых газов при одинаковой температуре и давлении имеют одинаковые объемы.
При нормальных условиях: V = 22,4×10-3м3/моль
В 1 моле различных веществ содержится одно и то же число молекул, называемое постоянной Авогадро
NA = 6,02×1023 моль-1
5) Закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений, входящих в нее газов.
p = p1 + p2 + . . . + pn – закон Дальтона
где p1, p2 , . . . pn – парциальные давления.
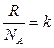 - постоянная Больцмана k = 1,38 ×10-23 Дж/К
- постоянная Больцмана k = 1,38 ×10-23 Дж/К
При одинаковых температурах и давлении все газы в единице объема содержат одинаковое число молекул.
Число молекул, содержащихся, в 1м3 газа при нормальных условиях называется числом Лошмидта NL = 2,68×1025 м3
Нормальные условия: р0 = 1,013×103 Па
V0 = 22,4×10-3м3/моль
Т0 = 273 К
R = 8,31 Дж/мольК
На основе использования основных положений молекулярно-кинетической теории было получено уравнение, которое позволяет вычислить давление газа, если известны m - масса молекулы газа, среднее значение квадрата скорости u2 и концентрация n молекул.
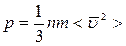 |
- основное уравнение молекулярно-кинетической теории
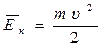 Средняя кинетическая энергия поступательного движения молекул
Средняя кинетическая энергия поступательного движения молекул
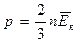 |
Тогда - первое следствие из основного уравнения МКТ
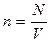
- концентрация молекул
Температура – есть мера средней кинетической энергии молекул.
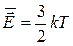
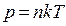 Тогда - второе следствие из основного уравнения МКТ
Тогда - второе следствие из основного уравнения МКТ
Теперь запишем <u> - среднюю квадратичную скорость движения молекул
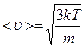
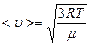
или
Средняя арифметическая скорость движения молекул определяется по формуле
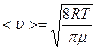 или
или 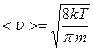
Молекулы, беспорядочно двигаясь, непрерывно сталкиваются друг с другом. Между двумя последовательными столкновениями молекулы проходят некоторый путь, который называется длиной свободного пробега.
Длина свободного пробега все время меняется, поэтому следует говорить о средней длине свободного пробега <l>, как о среднем пути, проходимом молекулой между двумя последовательными соударениями
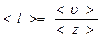 |
<z> - среднее число столкновений, испытываемых молекулой за 1с
<u> - средняя скорость.
Минимальное расстояние, на которое при столкновении сближаются центры двух молекул называется эффективным диаметром молекулы. – d.

 |
d
Среднее число столкновений за одну секунду равно числу молекул в объеме
<z> = nV, где n – концентрация молекул
V = pd2<u>
<z> =pd2n<u> при учете движения всех молекул
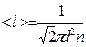
- средняя длина свободного пробега молекул
Тогда <z> = 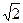 pd2n<u> - среднее число столкновений молекул за 1с.
pd2n<u> - среднее число столкновений молекул за 1с.
Таким образом, <l> обратно пропорциональна концентрации молекул.
Дата добавления: 2015-01-26; просмотров: 867;
