Полярность химической связи. Полярность молекул. Дипольный момент.
|
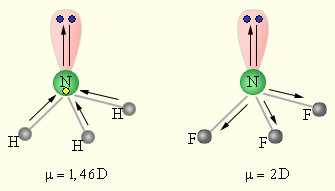
| Рисунок 3.1 Сложение дипольных элементов в молекулах NH3 и NF3 |
Полярность молекулы определяется разностью электроотрицательностей атомов, образующих двухцентровую связь, геометрией молекулы, а так же наличием не поделённых электронных пар, так как часть электронной плотности в молекуле может быть локализована не в направлении связей. Полярность связи выражается через ее ионную составляющую, то есть через смещение электронной пары к более электроотрицательному атому. Полярность связи может быть выражена через ее дипольный момент μ, равный произведению элементарного заряда на длину диполя *) μ = e ∙ l. Полярность молекулы выражается через ее дипольный момент, который равен векторной сумме всех дипольных моментов связей молекулы.
*) Диполь – система из двух равных, но противоположных по знаку зарядов, находящихся на единичном расстоянии друг от друга. Дипольный момент измеряется в кулон-метрах (Кл∙м) или в дебаях (D); 1D = 0,333∙10–29 Кл∙м.
Дата добавления: 2015-01-21; просмотров: 1666;
